DEVOIR SURVEILLE DE PHYSIQUE -CHIMIE (25/2/04)
EXERCICE 1 : La Radioactivité dans la famille de l'uranium
Données valables pour tout l’exercice :
| Unité de masse atomique | 1 u = 1,660 54 . 10-27 kg |
| Énergie de masse de l'unité de masse atomique | 1 u = 931,5 MeV/c2 |
| Électronvolt | 1 eV = 1,60 . 10-19 J |
| Megaélectronvolt | 1 MeV= 1 . 106 eV |
| Célérité de la lumière dans le vide | c = 3,00 . 108 m.s-1 |
| Nom du noyau ou de la particule | Radon | Radium | Hélium | Neutron | Proton | Électron |
| Symbole | ||||||
| Masse (en u) | 221,970 | 225,977 | 4,001 | 1,009 | 1,007 | 5,49 . 10-4 |
A. Désintégration du radium
L'air contient du radon 222 en quantité plus ou moins importante.
Ce gaz radioactif naturel est issu des roches contenant de l'uranium et du radium. Le radon se forme par désintégration du radium (lui-même issu de la famille radioactive de l'uranium 238), selon l'équation de réaction nucléaire suivante :
1. Quel est le type de radioactivité correspondant à cette réaction de désintégration ? Justifier votre réponse.
2.Défaut de masse
a) Donner l'expression littérale du défaut de masse
Dm (X) d’un noyau de symboleb) Calculer le défaut de masse du noyau de radium
3. Écrire la relation d'équivalence masse-énergie et préciser les unités.
4. Le défaut de masse
Dm (Rn) du noyau de radon Rn vaut 3,04 . 10-27 kg.a) Définir l'énergie de liaison El (X) d'un noyau X et donner son expression littérale.
b) Calculer, en joule, l'énergie de liaison E
l (Rn) du noyau de radonc) Vérifier que cette énergie de liaison vaut 1,71 . 103
MeV en détaillant le calcul.d) En déduire l'énergie de liaison par nucléon El(Rn)/A , exprimée en MeV/nucléon ,du noyau de radon
5.Bilan énergétique
a) Établir littéralement la variation d'énergie
DE de la réaction (1) en fonction de m(Ra), m(Rn) et m(He) masses respectives des noyaux de radium, de radon et d'hélium.b) Exprimer
DE en MeV.B. Fission de l'uranium 235
À l'état naturel, l'élément uranium comporte principalement les isotopes
Dans une centrale nucléaire « à neutrons lents » , le combustible est de l'uranium « enrichi ». Lors de la fission d'un noyau d'uranium 235, un grand nombre de réactions sont possibles.Parmi celles-ci, il y en a une qui donne les noyaux de zirconium et de tellure, dont les symboles des noyaux sont
1. Définir le terme « isotope ».
2. Intérêt énergétique de la fission
a) Donner la définition de la fission.
b) Écrire la réaction de fission d'un noyau d'uranium 235 bombardé par un neutron, conduisant à la formations de Zr , de Te et à plusieurs neutrons.
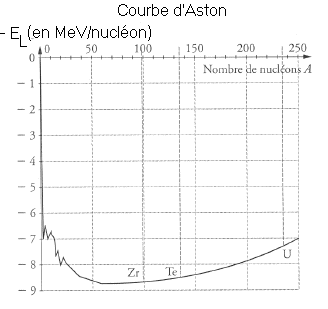
c) Les noyaux U, Zr et Te sont placés sur la courbe d'Aston (voir page 4 ). À partir de cette courbe, déterminer de manière approchée les énergies de liaison des noyaux U ,Zr et Te .
Remarque : l'énergie de liaison des neutrons est nulle .
d)En déduire le bilan énergétique en MeV de la réaction de fission .
C. Désintégration du noyau Zr
Le noyau Zr issu de la fission du noyau d'uranium est instable. Il se désintègre au cours d'une désintégration
b- en donnant le noyau de niobium Nb.1. Donner la définition de la radioactivité
b-2. Écrire l'équation de désintégration du noyau Zr sachant que le noyau fils , qu'on notera Y en indiquant son numéro atomique et son nombre de masse , est obtenu dans un état excité.
II/Réactions en solution aqueuse :
Données : les mesures sont effectuées à 25 °C
* acide éthanoïque/ion éthanoate : CH
3COOH/CH3COO- : pKa= 4,7 ;* ion ammonium /ammoniac : NH
4+/NH3 : pKa=9,2*H
3O+/H2O : pKa= 0 ; H2O/OH- : pKa=14Les questions I , II et III sont indépendantes .
I/Produit ionique de l'eau :
1-Qu'appelle t-on produit ionique de l'eau ?
2-Déterminer sa valeur à partir de l'une des données ci-dessus .
II/Réaction de l'acide éthanoïque et de l'eau :
On introduit de l'acide éthanoïque dans l'eau. On obtient une solution aqueuse S
1 de volume V1=10 mL, de concentration apportée en acide éthanoïque C1= 2 . 10-2 mol.L-1 . La mesure du pH de la solution S1 donne 3,2 .1-Ecrire l'équation de la réaction de l'acide éthanoïque avec l'eau. On note (1) cette réaction .
2-Tracer le diagramme de prédominance du couple acide éthanoïque/ion éthanoate. En déduire l'espèce prédominante dans la solution S
1 .3-Avancement de la réaction de l'acide éthanoïque avec l'eau
a/Déterminer l'avancement final x
1,f de la réaction de l'acide éthanoïque avec l'eau (on pourra s'aider d'un tableau d'avancement).b/Comprer x
1,f et l'avancement maximal x1,max (avancement final qui serait atteint si la transformation était totale).c/En déduire le taux d'avancement final
t1 de cette réactiond/Le résultat est-il cohérent avec celui de la question 2 ? Justifiez .
III/Réaction de l'ammoniac avec l'eau
Soit une solution préparée par dissolution dans l'eau d'ammoniac gazeux . On obtient une solution aqueuse S
2 de volume V2= 10 mL de concentration apportée en ammoniac C2 =1,0 .10-2 mol.L-1 .La mesure du pH de la solution S2 donne 10,6 .1-Ecrire l'équation de la réaction de l'ammoniac avec l'eau . On note (2) cette équation .
2-Tracer le diagramme de prédominance du couple ion ammonium/ammoniac. En déduire l'espèce prédominante dans S
2 .3-Déterminer le taux d'avancement final
t2 de cette réaction (on pourra s'aider d'un tableau d'avancement) .4- Le résultat est-il cohérent avec celui de la question III-2 ? Justifiez .
IV/Evolution d'un mélange d'acide éthanoïque et d'ammoniac dans l'eau .
On réalise une solution S de volume V=20 mL en introduisant dans l'eau 2 . 10
-4 mol d'acide éthanoïque et 1 . 10-4 mol d'ammoniac. On modélise la transformation qui a lieu par la réaction suivante :CH
3COOH + NH3 = CH3COO- + NH4+ (réaction 3)1-Calculer le quotient de réaction du système dans l'état initial Q
r,i .2-Comparer Q
r,i au quotient de réaction dans l'état d'équilibre Qr,eq . Que peut-on en déduire sur le sens d'évolution de la réaction 3 ?3-Justifiez , en utilisant la valeur numérique précedemment calculée de Q
r,eq , le caractère quantitatif de la réaction 3 .4-Que peut-on en déduire de l'avancement final x
3,f de la réaction 3 comparativement à x3,max ?5-A l'aide d'un bilan de matière dans l'état final , citer , pour chacun des couples CH
3COOH/CH3COO- et NH4+/NH3 , les espèces prédominantes dans la solution S .6-Expliquer pourquoi le pH de la solution S est égal à 4,7 .
Devoir surveillé de physique-chimie du 25/2/04 : correction
Exercice 1 : radioactivité :
A)Désintégration du radium :
1/Une particule alpha est un noyau d'hélium . Dans la réaction (1) , il s'agit donc d'une désintégration a .
2/- a: Dm = Zmp + (A-Z)mn - m(X)
b : Dm = 86*1,007 + (228-86)*1,009 - 225,977 = 3,903 u
3/La relation d'équivalence masse-énergie s'écrit E=m.c2 . la masse m s'exprime en kg , la célérité d de la lumière dans le vide s'exprime en m/s et l'énergie en Joule .
4/-a : L'énergie de liaison El(X) du noyau X esr l'énergie qu'il faut fournir pour séparer les constituants du noyan .
El(X) = Dm(X) * c2 .
b : EL(Rn) = 3,04 . 10-27*(3 . 108)2 = 2,7 . 10-10 J
c: 1 eV = 1,6 . 10-19 J et par conséquent EL(Rn)= 2,7 . 10-10 / 1,6 . 10-19 = 1710 . 106 ev = 1710 MeV
d: EL/A = 1710 / 222 = 7,70 MeV/nucléon
5/-a:DE = [ m(He) + m(Rn) - m(Ra)] c2
b: DE = (4,001 + 221,970 - 225,977) u*c2 = - 6 . 10-3 * 931,5 MeV/c2 * c2 = - 5,6 MeV
B/Fission de l'unarium 235 :
1 / deux isotopes sont deux atomes qui ont le même numéro atomique Z , mais un nombre de neutrons différents .
2/ -a: Au cours d'une fission , un noyau atomique ("lourd") est divisé en noyaux plus légers .
b: ![]()
c: Nous lisons sur la courbe d'Aston , les énergies de liaison par nucléon (attention au signe !) , et nous en déduisons les énergies de liaison correspondantes :
*uranium 235 : EL = 7,3 * 235 = 1715 MeV
*Zirconium 99 : EL= 8,8*99= 871 MeV
*Tellure 134 : EL= 8,5 * 134 = 1140 MeV
d:DE = EL(U) - EL(Zr) - EL(Te) = -290 MeV
C/Désintégration du noyau Zr
1- Les particules b- sont des électrons qui résultent de la transformation au sein d'un noyau ,d'un neutron en proton .
2-
![]()
![]() (retour à un état stable du noyau excité)
(retour à un état stable du noyau excité)
Exercice 2 :Réactions en solution aqueuse :
I/Produit ionique de l'eau
1-Le produit ionique de l'eau n'est autre que la constante d'équilibre de l'auto-protolyse de l'eau :
H2O + H2O = H3O+ + HO- K=Ke= [H3O+][HO-]
2- Sachant que Ka=10-pKa
![]() à 25 °C
à 25 °C
II/Réaction entre l'acide éthanoïque et l'eau :
1/ Réaction de l'acide éthanoïque avec l'eau :
CH3COOH + H2O = CH3COO- + H3O+
2/
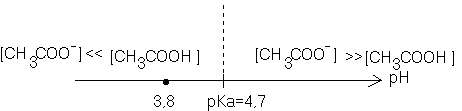
Comme pH= 3,8 , dans la solution , la forme acide CH3COOH prédomine sur la forme basique ( [CH3COOH] >>[CH3COO-] )
3/- a:
avancement |
CH 3COOH + H2O = CH3COO- + H3O+ |
|||||
Etat initial |
X=0 |
C 1V1 |
solvant |
0 |
0 |
|
Etat interm. |
X |
C 1V1-X |
X |
X |
||
Etat final |
X f |
C 1V1 - Xf |
X f |
X f |
||
Il est clair que :
Xf = [H3O+]*V1 = 10-pH * V1 = 10-3,2 *10 . 10-3 = 6,3 . 10-6 mol
b-CH3COOH est le réactif limitant . L'avancement maximal Xmax est tel que C1V1 - Xmax = 0 , d'où Xmax = 2.10-4 mol .
c-t1 = Xf/Xmax = 0,031 = 3,1 %
d-La réaction de l'acide éthanoïque avec l'eau est donc peu avancée , ce qui signifie que peu d'acide a réagi avec l'eau ( 3,1 %) et qu'il en reste beaucoup en solution (96,9 % de la quantité introduite) . Ainsi peu de base s'est formée (3,1 %) , ce qui signifie que la quantité d'acide prédomine nettement sur la quantité de base . Le résultat est par conséquent cohérent avec celui de la question 2 .
III/Réaction de l'ammoniac avec l'eau
1/NH3+ H2O = NH4+ + HO-
2/
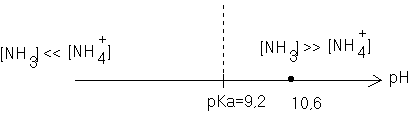
Comme pH= 10,6 , dans la solution , la forme basique NH3 prédomine sur la forme acide ( [NH3] >>[NH4+] )
3/
avancement |
NH 3 + H2O = NH4+ + HO- |
|||||
Etat initial |
X=0 |
C 2V2 |
solvant |
0 |
0 |
|
Etat interm. |
X |
C 2V2-X |
X |
X |
||
Etat final |
X f |
C 2V2 - Xf |
X f |
X f |
||
Il est clair que :
Xf = [HO-]*V1 = Ke/[H3O+] * V1 = 10-14/10-10,6 *10 . 10-3 = 3,98 . 10-6 mol
NH3 est le réactif limitant . L'avancement maximal Xmax est tel que C2V2 - Xmax = 0 , d'où Xmax = 1.10-4 mol .
t2 = Xf/Xmax = 4 %
4/La réaction de l'ammoniac avec l'eau est donc peu avancée , ce qui signifie que dans la solution , la quantité de base prédomine nettement sur la quantité d'acide . Ce résultat est en accord avec la question III-2 .
IV/Evolution d'un mélange acide éthanoïque/ammoniac .
1/ A l'état initial [NH4+]i = [CH3COO-]i = 0 mol/L et par conséquent :
![]()
2/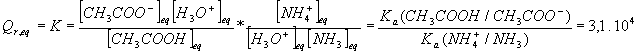
Il est clair que Qr,i < Qr,eq et par conséquent la réaction évolue de gauche à droite :
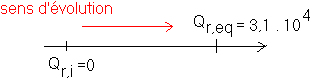
3/ Qr,eq > 104 : nous pouvons par conséquent considérer que la réaction (3) est quantitative .
4/Dans ces conditions X3,f = X3,mx (t3 = 100%)
5/les quantités de matière sont exprimées en mol .
avancement |
CH 3COOH + NH3 = CH3COO- + NH4+ |
|||||
Etat initial |
X=0 |
2 . 10 -4 |
1 . 10 -4 |
0 |
0 |
|
Etat interm. |
X |
2 . 10 -4 -X |
1 . 10 -4 - X |
X |
X |
|
Etat final |
X max = 10-4 mol |
2 . 10 -4 - Xmax |
1 . 10 -4 - Xmax=0 |
X max |
X max |
|
Du tableau cous déduisons :
n(CH
3COOH) = 1 . 10-4 mol ; n(NH3) = 0 mol ; n(NH4+) = 10-4 mol ; n(CH3COO-)= 10-4 mol .Les espèces qui prédominent à l'état final sont par conséquent CH
3COOH , CH3COO- et NH4+ .La quantité d'ammoniac n'est pas en fait exactement nulle , mais elle est très faible par rapport aux autres espèces .
6/De ce qui précède nous déduisons :
[CH
3COOH]eq = [CH3COO-]eq = 1.10-4/(20 . 10-3) = 5 . 10-3 mol/LDe la relation :
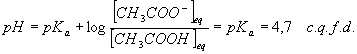
exercice complémentaire : calculer [NH
3]![]() et donc
et donc
![]()
Cet exercice a été tiré des annales 0 proposées par le ministère . On pourra comparer utiliement la présentation de la fin de cet exercie à celle qui est proposée dans les annales 0 (très instructif !) .