
Réactions en solution aqueuse
L'usage de la calculatrice est autorisé
Données : les mesures sont effectuées à 25 °C :
Acide éthanoïque / ion éthanoate : CH 3CO2 H / CH 3COO- : pKA,1 = 4,7
Ion ammonium / ammoniac : NH4+ / NH3 : pKA,2 = 9,2
H3O+ / H2O : pKA = 0
H2O / HO - : pKA = 14
Les questions 1, 2, 3 sont indépendantes.
1. Produit ionique de l'eau
1.1. Qu'appelle-t-on produit ionique de l'eau ?
1.2. Déterminer sa valeur à partir des données précédentes.
2. Réaction de l'acide éthanoïque et de l'eau
On introduit de l'acide éthanoïque pur dans de l'eau. On obtient une solution aqueuse S1 de volume V1 = 10 mL, de concentration apportée en acide éthanoïque C1 = 2,0 10-2 mol.L- 1. La mesure du pH de la solution S1 donne 3,2.
2.1. Écrire l'équation de la réaction de l'acide éthanoïque avec l'eau. On note (1) cette équation.
2.2. Tracer le diagramme de prédominance du couple acide éthanoïque / ion éthanoate. En déduire l'espèce prédominante dans la solution S1.
2.3. Avancement de la réaction de l'acide éthanoïque avec l'eau
2.3.a. Déterminer l'avancement final X1,f de la réaction de l'acide éthanoïque avec l'eau (on pourra s'aider d'un tableau d'avancement).
2.3.b. Comparer X1,f et l'avancement maximal X1,max ( avancement final qui serait atteint si la transformation était totale).
2.3.c. En déduire le taux d'avancement final t1 de cette réaction.
2.3.d. Le résultat est-il cohérent avec celui de la question 2.2 ? Justifier.
3. Réaction de l'ammoniac avec l'eau
Soit une solution préparée par dissolution dans l'eau d'ammoniac gazeux. On obtient une solution aqueuse S2 de volume V2 = 10,0 mL, de concentration apportée en ammoniac C2 = 1,0 . 10-2 mol/L . La mesure du pH de la solution S2 donne 10,6.
3.1. Écrire l'équation de la réaction de l'ammoniac avec l'eau. On note (2) cette équation.
3.2. Tracer le diagramme de prédominance du couple ion ammonium / ammoniac. En déduire l'espèce prédominante dans S2.
3.3. Déterminer le taux d'avancement final t2 de cette réaction (on pourra s'aider d'un tableau d'avancement). Le résultat est-il cohérent avec celui de la question 3.2 ? Justifier.
4. Evolution d'un mélange d'acide éthanoïque et d'ammoniac dans l'eau.
On réalise une solution S de volume V = 20 mL en introduisant dans l'eau 2.10-4 mol d'acide éthanoïque et 1. 10-4 mol d'ammoniac. On modélise la transformation qui a lieu par la réaction suivante :
CH3COOH + NH3 = CH3COO- + NH4+ (3)
4.1. Calculer le quotient de réaction du système dans l'état initial Qr,i .
4.2. Comparer Qr,i au quotient de réaction dans l'état d'équilibre Qreq . Que peut-on en déduire ?
4.3. Exprimer Qreq en fonction de l.avancement maximal X3,f de la réaction (on pourra s'aider d'un tableau). En déduire la valeur de X3,f . La comparer à la valeur de l'avancement maximal X3,max.
4.4. La transformation du système peut-elle être considérée comme totale ? A l'aide du bilan de matière dans l'état final, citer, pour chacun des couples CH3CO2H / CH3COO- et NH4+/NH3 , les espèces prédominantes dans la solution S.
Expliquer pourquoi la valeur du pH de la solution S est égale à 4,7.
Réactions en solution aqueuse : Correction
1.Produit ionique de l'eau :
1.1 K e = [H3O+][HO-]
1.2 Pour H 2 O/ OH- ? H 2 O + H 2 O = OH - + H 3 O+ ? pK A = 14
K =K A = K e = 10-14
2.Réaction de l'acide éthanoïque avec l'eau :
2.1 : CH3COOH + H2O = CH3COO- + H3O+ (1)
2.2 :

Ici pH=3,2 : c'est donc l'acide éthanoïque qui prédomine
2.3-a:
| CH3COOH + | H2O = | CH3COO- | + H3O+ | ||
| EI | X1=0 | C1V1 | 0 | 0 | |
| En cours | X1 | C1V1-X1 | X1 | X1 | |
| E. Final | X1,f | C1V1 - X1,f | X1,f | X1,f |
avec [H3O+] =X1,f/V1 = 10-pH
2.3.b :X1,max = C1V1 = 2 10-4 mol X1,f = 10-3,2 * 10 10-3 = 6,3 10-6 mol : la réaction n'est pas totale .
2.3.c : tf = X1,f/Xmax = 0,03 = 3%
2.3d : Seulement 3% de l'acide éthanoïque a réagi . L'espèce qui prédomine est bien l'acide éthanoïque .
3.Réaction de l'ammoniac avec l'eau
3.1 NH3 + H2O = NH4+ +HO- (2)
3.2
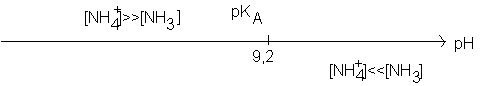
Ici pH = 10,6 (>9,2) : c'est donc la base du couple qui prédomine , c'est à dire NH3 .
3.3
| NH3 + | H2O = | NH4+ | + HO- | ||
| EI | X2=0 | C2V2 | 0 | 0 | |
| En cours | X2 | C2V2-X2 | X2 | X2 | |
| E. Final | X2,f | C2V2 - X2,f | X2,f | X2,f |
avec [HO-] = Ke/[H3O+] = Ke/10-pH = X2,f/V2 .
X2,f = Ke*V2/10-pH = 3,9 10-6 mol X2,max= 10-4 mol tf = 4 10-2
Autrement dit , la réaction de l'ammoniac avec l'eau est très limitée : ce résultat est en accord avec 3.2 , c'est bien l'ammoniac qui prédomine .
4.Acide éthanoïque -ammoniac :
4.1 :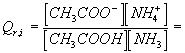 0 car on n'apporte pas d'ions ammonium , ni d'ions
éthanoates au départ .
0 car on n'apporte pas d'ions ammonium , ni d'ions
éthanoates au départ .
4.2 ![]() et donc Qr,i < Qr,eq : la
transformation a lieu dans le sens direct .
et donc Qr,i < Qr,eq : la
transformation a lieu dans le sens direct .
4.3
| CH3COOH + | NH3 = | CH3COO- | + NH4+ | ||
| EI | X3=0 | 2 10-4 | 10-4 | 0 | 0 |
| En cours | X3 | 2 . 10-4 -X3 | 10-4 - X3 | X3 | X3 |
| E. Final | X3,f | 2 . 10-4 -X3,f | 10-4 - X3,f | X3,f | X3,f |
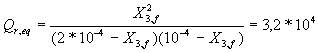
La résolution de l'équation du second degré donne X3,f de l'ordre de 10-4 mol , c'est à dire que X3,f=X3,max et par conséquent tf = 1
4.3 La transformation chimique peut donc être considérée comme totale . Dans la solution S les ions ammonium prédominent , l'ammoniac ayant pratiquement disparu .
Les ions éthanoate et l'acide éthanoïque sont en même quantité : 10-4 mol et par conséquent pH = pKA,1 = 4,8