TS10 - DEVOIR SURVEILLE DE PHYSIQUE CHIMIE (1/4/03)
Exercice 1 : Mobile sur une table horizontale .(11 points)
Les questions A, B, C et D sont mdependantes.
On considere sur une table horizontale un. mobile autoporteur S ( solide sur coussin d'air), de masse m = 800 g, relié a un point fixe 0 par un fil inextensible de masse negligeable.
Apres le lancement du mobile, on enregistre a intervalles de temps egaux a
t = 20 ms, les projections Mi des positions successives du centre d'inertie G du mobile.Apres avoir décrit une partie de la trajectoire, au cours de laquelle le fil est tendu, ce dernier casse et, un peu plus tard la turbine qui éjecte l'air ne fonctionne plus.
L'enregistrement obtenu est represente en annexe( flgure l).
A. NATURE DES DIFFERENTS MOUVEMENTS
On constate sur l'enregistrement qu'il y a trois phases distinctes au cours du mouvement de S.
Donner sous la forme M
iMj les limites de chacune des phases.Donner la nature des differents mouvements de G, en justifiant sans calcul votre reponse.B. ETUDE DE LA PREMIERE PHASE
1/Définier les vecteurs vitesse (définition approchée) ![]()
2/A partir de l'enregistrement , déterminer pour les positions M
3 et M5 les valeurs(normes)des vitessesEchelle: 1 cm pour 0,15 m/s
Le vecteur vitesse de G est-il constant ou variable? Justifiez votre réponse.
3/ Le vecteur accélération ![]() est défini par
l'égalité (définition approchée)
est défini par
l'égalité (définition approchée) 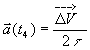 en ayant posé
en ayant posé ![]() .
.
a-Construire le vecteur
sur le document .
b-Déterminer la norme du vecteur .Représentez ce vecteur (échelle : 1 cm pour 1 m.s
-2) sur le document (figure 1) en justifiant la construction.4-Représentez sur la figure 2 les forces appliquées au mobile pendant cette première phase (il n'est pas demandé de les représenter à l'échelle) .
5- Enoncez la seconde loi de Newton (ou théorème du centre d'inertie)
6 - En déduire la norme de la tension ![]() du fil pendant cette première phase .
du fil pendant cette première phase .
C- ETÜDE DE LA DEUXIEME PHASE
l- Representer sur la figure 3 les forces qui s'exercent sur le solide.
2-Enoncer le principe qui permet de justifier la nature du mouvement pendant la phase 2.
3 -Calculer la vitesse du mobile ![]() pendant la seconde phase .
pendant la seconde phase .
D- ETUDE DE LA TROISIEME PHASE
La vitesse du mobile s'annule en M
27 . On admet la relation
Exercice 2 : La pile Daniell (9 points)
Une pile Daniell est constituée de deux compartiments reliés entre eux par un pont salin .Un compartiment est constitué d'une électrode de cuivre (métal) plongée dans une solution d'ions Cu
2+aq , L'autre compartiment ,est constitué d'une lame de zinc plongée dans une solution d'ions Zn2+aq . On mesure la différence de potentiel entre la lame de cuivre et la lame de zinc en utilisant un voltmètre dont la borne com est reliée à la lame de zinc UCu,Zn = 1,0 V. A l'intérieur de la pile on a les concentrations initiales suivantes : [Cu2+]i = [Zn2+]i= 0,1 mol.L-1 . Le volume de liquide est 20 mL dans chaque compartiment et les compartiments sont reliés entre eux par un pont salin .1/On réunit les deux pôles par un circuit de résistance 20
W . Faire un schéma de la pile avec le circuit ainsi réalisé . Indiquez sur le schéma* le pôle positif et le pôle négatif de la pile .
* le sens du courant à chacune des électrodes
* le sens de daplacement des électrons à chacune des électrodes .
2/-a :Ecrire les équations des réactions aux électrodes
b: En déduire l'équation de la réaction globale de la pile .
c: Calculer le quotient de la réaction à l'état initial .
d :Cette réaction a une constante d'équilibre de valeur très élevée . Que peut-on en déduire sur l'évolution de la réaction au cours du fonctionnement de la pile ?
3/L'intensité du courant est égale à 50 mA .En déduire la quantité d'électricité Q
h (valeur absolue) qui traverse la pile pendant une heure de fonctionnement .4/a)Dresser les tableaux descriptifs (adopter la présentation ci-dessous) relatifs aux réactions d'électrode (deux tableaux) .
| Réaction | Ox + n e- = red | qté d'e échangés | ||||
| Etat du système | avancement | Qté de matière | ||||
| Etat initial | 0 |
0 |
||||
| instant t | X |
|||||
b)Indiquez les relations qui relient Q
h aux avancements de ces réactions .c)Déterminer alors les concentrations des espèces en solution au bout d'une heure de fonctionnement de la pile dans les conditions de l'énoncé .
d)Calculer la masse de zinc consommée par heure dans cette pile .
e)La masse de zinc disponible dans la pile est de 5 g. Déterminer le réactif limitant,puis indiquer combien de temps la pile peut fonctionner dans les conditions de l'énoncé .
Données :M(Zn) = 65,4 g.mol
-1 ; 1 Faraday (F) = NA.e = 96500 C.mol-1 .
DS du 1/4/03 - Correction
Exercice 1 :
A/
M0M14 : mouvement circulaire(la trajectoire est un cercle) uniforme (la vitesse est constante car la distance entre les points est constante)
M14M21 : mouvement rectiligne(la trajectoire est une droite) uniforme (vitesse constante)
M21M27 : mouvement rectiligne retardé (la vitesse diminue)
B/
1- 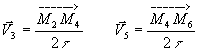
2- ![]()
V3=V5 = 0,7 m/s . Les deux vecteurs ![]() , sont respectivement colinéaires à
, sont respectivement colinéaires à ![]() et
les flèches qui les représentent ont une longueur de 0,70/0,15= 4,6 cm
et
les flèches qui les représentent ont une longueur de 0,70/0,15= 4,6 cm
Le vecteur vitesse de G n'est pas constant , car sa direction change .
3-a: construction de ![]()
b: La flèche associée à ![]() a une
longueur de 1,4 cm ce qui signifie
a une
longueur de 1,4 cm ce qui signifie ![]() et
par conséquent
et
par conséquent 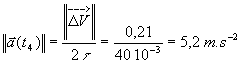
Le vecteur accélération est colinéaire à ![]() et tenant compte de l'échelle , il est représenté par une flèche
de longueur 5,2 cm .
et tenant compte de l'échelle , il est représenté par une flèche
de longueur 5,2 cm .
4-Pendant la première phase , le mobile est soumis à 3 forces :
son poids ![]() (action à distance) , la
tension du fil
(action à distance) , la
tension du fil ![]() (action de contact) et
l'action
(action de contact) et
l'action ![]() de la table (action de contact
normale aux surfaces en contact car il n'y a pas de frottement) .
de la table (action de contact
normale aux surfaces en contact car il n'y a pas de frottement) .

5-Deuxième loi de Newton : La somme vectorielle des forces extérieures appliquées à un solide est égale au produit de la masse du solide multipliée par le vecteur accélération du centre d'inertie du solide :
![]()
6-Dans le cas présent ![]() (pas de mouvement vertical) et par conséquent , la seconde loi de Newton ,
se réduit à :
(pas de mouvement vertical) et par conséquent , la seconde loi de Newton ,
se réduit à : ![]() et donc T=m.a= 0,8*5,2 =
4,2 N
et donc T=m.a= 0,8*5,2 =
4,2 N
C/-1: Pendant la seconde phase , les deux seules forces
appliquées sont le poids ![]() et l'action de
la table
et l'action de
la table ![]()
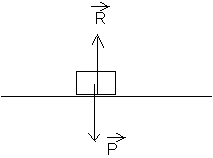
2-La somme vectorielle des forces appliquées au mobile est nulle (système pseudo-isolé) et en raison de la première loi de Newton (ou principe d'inertie) , le centre d'inertie du mobile a un mouvement rectiligne uniforme .
3-Vphase 2=M15M16/t = 1,4/20 10-3 = 70 cm/s
D/
a3= 0,72/(2*4,5 10-2 )= 5,4 m.s-2 .
Exercice 2 :
1/
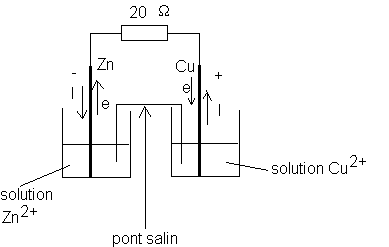
Le voltmètre mesure UV,com et ici, d'après les branchements effectués UV,com= UCu,Zn=1 V . Comme , pour une pile UPN >0 , nous pouvons en déduire que le cuivre constitue le pôle positif .
2/-a : Etant donné le sens de déplacement des électrons au niveau des électrodes , nous en déduisons les réactions aux électrodes :
* pole positif : Cu2+ + 2e ------> Cu
* pôle négatif : Zn -------> Zn2+ + 2e
b- d'où la réaction glogale du fonctionnement de la pile :
Cu2+ + Zn -------> Cu + Zn2+ .
c- 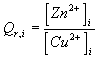 = 1
= 1
d-Au cours du fonctionnement de la pile , le quotient réactionnel tend vers la constante d'équilibre K de la réaction . Comme ici , Qr,i << K , la réaction écrite ci-dessus , évolue dans le sens direct .
3/Qh = I Dt = 50 10-3 * 3600 = 180 C
4/-a :
* Au pôle positif :
| Réaction | Cu2+ + 2 e- = Cu | qté d'e échangés | |||||
| Etat du système | avancement | Qté de matière | |||||
| Etat initial | 0 |
2 mmol | 0 | 0 |
|||
| instant t | X en mmol |
2-X | X | 2X |
|||
* Au pôle négatif
| Réaction | Zn = 2e + Zn2+ | qté d'e échangés | ||||
| Etat du système | avancement | Qté de matière | ||||
| Etat initial | 0 |
ni(Zn) | 2 mmol | 0 |
||
| instant t | X en mmol |
ni-X | 2+X | 2X |
||
b: Qh = 2X*NA*e
c: [Cu2+] = (2.10-3-Xen mol)/V = (2.10-3-Qh/2F)/V =0,053 mol/L
[Zn2+] = (2.10-3+Xen mol )/V= 0,146 mol.L-1 .
d : m(Zn)= X*MZn = Qh/2F= 180/(2*96500)* 65,4 =61 mg
e : ni(Zn) = 5/65,4 = 0,076 mol
Par conséquent Xmax = 2 10-3 mol .Cu2+ est le réactif limitant .
2Xmax * F = I * Dt d'ou Dt = 7720 s = 2 h 8 mn