TS 708 PHYSIQUE-CHIMIE – DEVOIR SURVEILLE (12/12/06)
Les calculatrices sont autorisées .
Exercice 1 : Onde progressive (6 points)
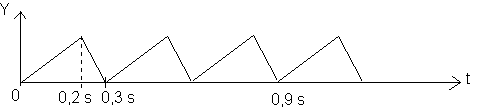
Un vibreur fixé en un point O à fil tendu horizontal est animé d'un mouvement vertical dont l'évolution en fonction du temps est représentée sur la figure ci-dessous :

L'ébranlement se propage le long du fil avec une célérité de 40 cm/s . A l'autre extrêmité du fil , on a installé un dispositif anti-réflexion .
a)Déterminer la période temporelle T du mouvement du point O .
b)Calculer la longueur d'onde de l'onde qui se propage le long du fil .
c)Quelle est la période temporelle des mouvements de deux points M1 et M2 du fil situés respectivement à 8 cm et 12 cm de O ?
d)Des points M1 et M2 quel est celui qui vibre en phase avec 0 ? Justifiez votre réponse .
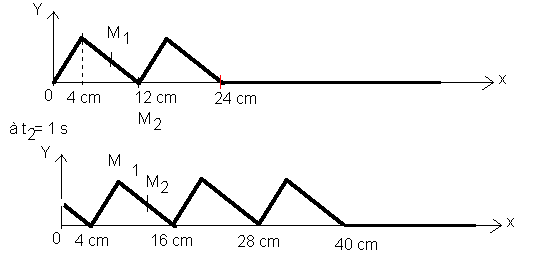
e)Représentez sur votre copie l'aspect du fil aux instants t1 = 0,6 s et t2 = 1 s (deux schémas ). Dans les deux cas on fera apparaître clairement le front de l'onde en donnant sa distance par rapport au point O .
f)Sur chacun des deux schémas précédents , situer les points M1 et M2 .
Exerxice 2 : Sens de propagarion de l'onde ? (1,5 point)
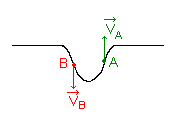
Il s'agit de résoudre l'énigme suivante:
On a représenté ci-dessus une corde perturbée par une onde à l'instant t ainsi que les
vecteurs vitesse de deux points atteints par cette onde.
Quel est le sens de propagation de l'onde sur la corde?
Justifiez clairement votre réponse .
Exercice 3 : L'acide nitreux : (5,5 points)
L'acide nitreux a pour formule HNO2 . Dans tout l'exercice , on ne tiendra pas compte de l'autoprotolyse de l'eau .
1/a: Ecrire la réaction de l'acide nitreux avec l'eau .
b: Justifiez qu'il s'agit bien d'une réaction acido-basique et préciser les couples mis en jeu .
2/On introduit de l'acide nitreux dans de l'eau. On obtient alors une solution de volume V1=500 mL et dont la concentration molaire apportée est C1=5,0.10-3 mol.L-1 . La mesure du pH de cette solution donne 3,0 .
a-Déterminer l'avancement final x1,f de la réaction (on pourra s'aider d'un tableau).
b-Calculer l'avancement maximal x1,max de la réaction .
c-En déduire son taux d'avancement final t1 et conclure .
d-Calculer le quotient de réaction Qr1,eq une fois que le système chimique a atteint l' équilibre .
e-Pourquoi dit-on que l'équilibre ainsi obtenu est dynamique ?
3/La mesure du pH d'une solution d'acide nitreux de concentration molaire apportée C2=1,4.10-4 mol.L-1 est 4 .Des calculs analogues à ceux de la question précédente montrent que le taux d'avancement final de la réaction est t2 = 71 % et que le quotient de réaction à l'équilibre est Qr2,eq =2,5.10-4 .
a-Que peut-on dire quant à l'influence de la dilution sur la dissociation de l'acide nitreux ?
b-De quel(s) facteur(s) dépend la constante d'équilibre ? Détaillez votre réponse .
IV/Exercice 4 :Solution aqueuse ammoniacale : (7 points)
La concentration molaire apportée d'une solution aqueuse d'ammoniac NH3 a pour valeur C=5.10-3 mol.L-1 . La conductivité s de la solution est s =70,0 µS.cm-1 .
On donne les conductivités molaires ioniques : lHO- = 19,8 mS.m2.mol-1 ; lNH4+ = 7,34 mS.m2.mol-1
1/-a:L'ammoniac NH3 est une base . Préciser à quel couple acide/base il appartient .
b:Ecrire l'équation de la réaction associée à la transformation de l'ammoniac au contact avec l'eau .
c-Recenser les espèces présentes dans la solution .
d-Exprimer la conductivité s de la solution ainsi réalisée en fonction des conductivités molaires ioniques est des concentrations effectives des ions présents dans la solution .
e-Montrer que si l'on ne tient pas compte de l'autoprotolyse de l'eau , les concentrations effectives en ions hydroxyde HO- et ammonium NH4+ sont égales (on pourra utiliser un tableau d'avancement ) . Comparer ces concentrations à l'avancement volumique à l'équilibre Yeq de la réaction .
f:On admet que le milieu est "suffisamment" basique (pH>8) . Justifiez le fait que l'on puisse alors négliger [H3O+]eq devant [HO-]eq
g-Dans l'hypothèse où le milieu est "suffisamment" basique (les conductivités molaires ioniques des ions hydroxyde et des ions oxonium étant du même ordre de grandeur) ,exprimer s en fonction de Yeq et des conductivités molaires ioniques des ions présents dans la solution.
h-Calculer les concentrations à l'équilibre [HO-]eq , [NH4+]eq et [NH3]eq
2/Donner l'expression de la constante d'équilibre K associée à la réaction entre l'ammoniac et l'eau et calculer sa valeur .
3/-a:Donner la définition de la constante d'acidité KA du couple auquel appartient l'ammoniac NH3 .Exprimer celle-ci en fonction de la constante K et du produit ionique Ke de l'eau .
b:Calculer numériquement la constante d'acidité KA et le pKA associé .
Donnée : Ke = 10-14 à 25 °C
4/-a:Vérifier que le pH de la solution est 10,4
b:Indiquer les domaines de prédominance de l'ammoniac et de l'ion ammonium en fonction du pH .
c:Quelle est l'espèce prédominante à pH= 10,4 ?
TS 708 – Correction du DS du 12/12/06
Exercice 1 :
a)T=0,3 s
b)l= V.T = 40 * 0,3 = 12 cm
c)La période temporelle des mouvements de la corde est la même pour tous les points (propagation de la perturbation initiale ) : Donc M1 et M2 ont la même période temporelle .
d)Des points distants d'une longueur d'onde ou d'un multiple de la longueur d'onde vibrent en phase . C'est le cas de O et M2 qui vibrent par conséquent en phase .
e)A t1= 0,6 s , le front d'onde s'est déplacé de 0,6 * 40 = 24 cm . A t= 1 s , le front d'onde s'est déplacé de 40 cm . Les aspects de la corde sont par conséquent :
* à t1= 0,6 s :
Exercice 2 :
La déformation est descendante : B est donc à "l'avant" de l'onde et A à "l'arrière ": l'onde se propage de droite à gauche .
Exercice 3 : l'acide nitreux :
1/-a : HNO2 + H2O = NO2- + H3O+
b: il y a échange de proton entre l'acide nitreux et l'eau :
HNO2 = NO2- + H+ et H2O + H+ = H3O+
c'est donc bien une réaction acido-basique . Les couples mis en jeu sont (HNO2/NO2-) et (H3O+/H2O)
2/-a :
HNO2 + H2O = NO2- + H3O+ |
|||||
EI |
X=0 mol |
2,5.10-3 |
excès |
0 |
(0) |
Etat final |
Xeq |
2,5.10-3 - Xeq |
excès |
Xeq |
Xeq |
Xmax= 2,5.10-3 mol |
0 |
excès |
Xmax |
Xmax |
|
Xeq = X1,f = [H3O+] * V1 = 10-pH * 0,5 = 5.10-4 mol
b: X1,max = 2,5.10-3 mol (si la réaction était totale , il ne resterait plus d'acide nitreux à la fin de la réaction)
c: t1 = X1,f/X1,max = 0,2 =20 % . La réaction de l'acide nitreux avec l'eau est par conséquent limitée .
d: 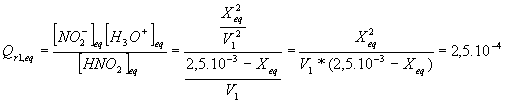
e:L'équilibre est dit dynamique , car bien que macroscopiquement , les quantités de réactifs et de produits ne varient plus lorsque l'équilibre est atteint , les réactions directe et inverse , continuent à se produire .
3/-a: Comme t2 > t1 , nous pouvons en conclure que la dilution favorise la dissocoation de l'acide nitreux .
b: Il est clair que K=Qr,eq a la même valeur pour les deux solutions . Autrement dit , la constante d'équilibre est indépendante de la concentration initiale des réactifs .Par contre , K dépend de la température .
IV/Solution aqueuse ammoniacale
1/-a : NH3 appartient au couple (NH4+/NH3)
b: NH3 + H2O = NH4+ + HO- (1)
c: Les espèces présentes dans la solution d'ammoniac sont : NH3 , NH4+ , HO- , H2O et H3O+ (ces derniers proviennent de l'autoprotolyse de l'eau)
d: Les seules espèces ioniques en solution étant NH4+ , HO- et H3O+
s= lHO-* [HO-]eq + lNH4+*[NH4+]eq+ lH3O+*[H3O+]eq
e:
NH3 + H2O = NH4+ + HO- |
|||||
EI |
X=0 mol |
n0 |
excès |
0 |
(0) |
Etat final |
Xeq |
n0 - Xeq |
excès |
Xeq |
Xeq |
Ne pas tenir compte de l'autoprotolyse de l'eau c'est admettre que dans l'état initial la quantité de HO- est nulle.Le tableau d'avancement fait alors qpparaître que [NH4+]eq* V=[HO-]eq*V =Xeq où V est le volume de la solution .
Comme Yeq = Xeq/V , nous obtenons finalement Yeq = [NH4+]eq=[HO-]eq
f: pH>8 : cela signifie aussi que [H3O+] < 10-8 mol.L-1 . Comme par ailleurs [H3O+][HO-]= 10-14 (produit ionique de l'eau à 25°C), il est clair que [HO-] >10-6 mol.L-1 d'où [HO-]>> [H3O+] . [H3O+] est donc négligeable devant [HO-].
g: L'hypothèse précédente étant retenue , nous pouvons alors écrire :
s= lHO-* [HO-]eq + lNH4+*[NH4+]eq = (lHO- + lNH4+)* Yeq
h: Application numérique :
[NH4+]eq=[HO-]eq= Yeq
=![]()
Or n0= CV = 5.10-3*V et à l'équilibre (tableau d'avancement) : [NH3]eq = (n0-Xeq)/V = C-Yeq= 47,5.10-4 mol.L-1
2/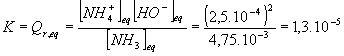
3/-a: 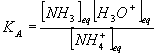
La constante d'acidité d'un couple acide/base est égale à la constante d'équilibre de la réaction de l'acide avec l'eau (NH4+ + H2O = NH3 + H3O+)
Partant de l'expression de K (question 2) , en multipliant numérateur et dénominateur par [H3O+]eq , nous obtenons :
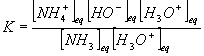
Expression que nous pouvons aussi écrire :
![]()
b: KA = 10-14 /1,3.10-5 =7,7.10-10
pKA= - log KA = 9,1
4/-a: [H3O+]eq = 10-14/[HO-]eq = 4.10-11 mol.L-1
pH=-log[H3O+]= 10,4 c.q.f.d.
b: * si pH < pKA (ou pH < 9,1) : c'est la forme acide NH4+ qui prédomine sur la forme basique NH3 .
* si pH>pKA (ou pH >9,1) : c'est la forme basique NH3 qui prédomine sur la forme acide NH4+
c:A pH=10,4 , nous sommes dans le second cas , c'est à dire que c'est NH3 qui prédomine sur NH4+ .