PHYSIQUE- CHIMIE - DEVOIR SURVEILLE - TS10 (26/11/03)
I/Comportement d'une bobine : (10 points)
Les deux parties sont indépendantes
Partie 1 :
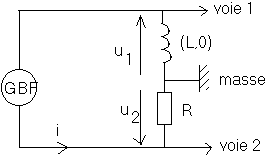
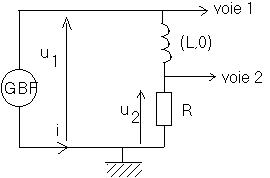
Le circuit comporte, en série, un conducteur ohmique de résistance R=300
W et une bobine idéale (de résistance négligeable) d'inductance propre L .Le courant imposé dans ce circuit est un courant en dent de scie délivvré par un générateur basse fréquence .
On visualise sur l'écran d'un ordinateur, les tensions u
1 et u2 en fonction du temps .
La bobine d'inductance L est idéale .
1/Déterminer les expressions des tensions u
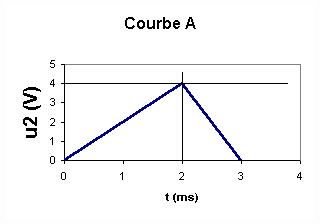
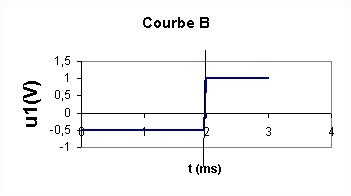
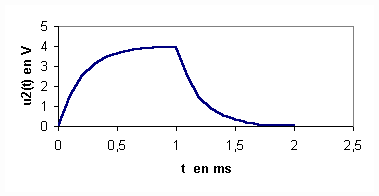
1 et u2 en fonction de L,R,i et di/dt .2/Des deux courbes représentées ci-dessous , quelle est celle qui permet de visualiser l'intensité du courant dans le circuit ? Justifiez votre réponse .
3/Montrer que l'inductance L de la bobine est :
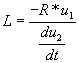
4/Calculer la valeur de L à partir des deux courbes représentées ci-dessus .
Partie 2 :
Soit le montage ci-dessous dans laquel le G.B.F. délivre une tension créneau modélisant l'ouverture et la fermeture d'un circuit RL .
Les évolutions temporelles des tensions u
1 et u2 sont représentées ci-dessous :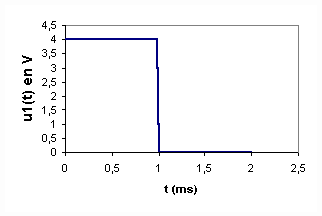
1/Quel est le phénomène physique mis en évidence ?
2/Déduire la période et la fréquence de la tension d'alimentation du montage.
3/Donner un ordre de grandeur de la constante de temps du circuit RL en utilisant la méthode de votre choix que l'on précisera clairement en utilisant un schéma .
4/En déduire un ordre de grandeur de la valeur de l'inductance L de la bobine .
II/Conservation du vinaigre : (10 points)
Un industriel produit du vinaigre par oxydation ménagée d'une solution aqueuse d'éthanol par l'oxygène de l'air . Cette transformation est effectuée en milieu acide. Il obtient un vinaigre à 6 ° , soit une solution aqueuse d'acide éthanoïque contenant 6 g d'acide éthanoïque pur pour 100 g de solution de masse volumique 1 kg.L
-1 et de pH = 2,3Les couples oxydant/réducteur intervenant dans la réaction sont O
2/H2O et CH3COOH/CH3CH2OH1-a:Ecrire les demi-équations électroniques de ces deux couples .
b:En déduire que l'équation de la transformation s'écrit :
CH
3CH2OH + O2 = CH3COOH + H2O2/Calculer la concentration initiale (avant la réaction avec l'eau) en acide éthanoïque dans le vinaigre.
3/-a: Ecrire l'équation chimique de la réaction entre l'acide éthanoïque et l'eau .
b:Déterminer le taux d'avancement final. En déduire si la transformation est totale ou limitée (On pourra utiliser un tableau d'avancement - Celui-ci n'est toutefois pas exigé ici)
4/Calculer les concentrations des espèces présentes à l'état final.
5/L'industriel souhaite introduire un conservateur utilisé dans l'alimentation ; il ajoute 1,00 g de benzoate de sodium, de formule C
6H5COONa , à 1,00 litre de vinaigre.Le benzote de sodium est un composé ionique et dans l'eau il se dissocie totalement en libérant des ions benzoate C
6H5COO- et des ions Na+ selon l'équation de dissolution :C
6H5COONas = C6H5COO- + Na+ (l'indice "s" signifie "solide")L'ion Na
+ est ici une espèce inerte .Quelle est la concentration des ions benzoate dans le vinaigre (on considère que ceux-ci ne réagissent pas avec l'eau) ?
6/En réalité , les ions benzoate réagissent avec l'acide éthanoïque. Cette transformation n'est pas totale .
a:Donner les couples acide/base auxquels appartiennent l'acide éthanoïque et l'ion benzoate .
b:Ecrire l'équation chimique de la réaction entre les ions benzoate et l'acide éthanoïque.
c:Donner l'expression du quotient de réaction à l'équilibre .
d:Construire le tableau descriptif de l'évolution du système chimique en utilisant l'avancement volumique .
7/La constante d'équilibre de la réaction entre l'acide éthanoïque et les ions benzoate est K =2,51 . 10
-1 à 25 °C .a:Exprimer la constante d'équilibre K en fonction de l'avancement volumique y
eq à l'équilibre et des concentrations initiales des réactifs .b:En résolvant une équation du second degré , calculer y
eq .c:L'ajout du conservateur modifie t-il notablement la concentration en acide éthanoïque du vinaigre ?
Données : Masses molaires
M(CH
3COOH) = 60 g.mol-1 ; M(C6H5COONa)= 144 g.mol-1 .
Correction :
I/Comportement d'une bobine :
Partie 1 :
1/ u2 = Ri et u1 = - Ldi/dt
2/La courbe A permet de visualiser i car u2 et i sont deux grandeurs proportionnelles . Donc visualiser u2 , c'est visualiser i à une constante multiplicative près .
3/![]()
Cette expression s'écrit aussi : 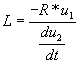 c.q.f.d.
c.q.f.d.
4/u2 est une fonction affine par morceaux et en considérant par exemple l'intervalle de temps [0,2 ms] , nous pouvons écrire : u2 = a*t , a étant le coefficient directeur de la droite correspondante .
Il est clair que : du2/dt = a = 4/2 V.ms-1= 2 V.ms-1 = 2000 V.s-1 et donc :
![]()
Partie 2 :
1/ u2 est proportionnelle au courant et il est clair que le courant dans le circuit ne "suit" pas la tension imposée aux bornes du dipôle RL par le GBF : le courant est en retard sur la tension . Le phénomène mis en évidence est l'auto-induction .
2/T=2 ms ; f=1/T = 1/(2.10-3) = 500 Hz
3/La tangente en t=0 à la courbe u2(t) coupe l'asymptote d'équation u2,lim= 4 V à l'abscisse t=t .
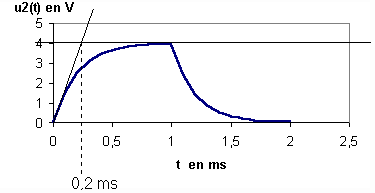
la construction graphique donne t=0,2 ms
4/t=L/R d'où L= t*R = 0,2 . 10-3 * 330 = 0,066 H = 66 mH . Compte tenu du manque de précision de la construction graphique , nous retrouvons pratiquement la même valeur que celle trouvée dans la première partie .
II/Conservation du vinaigre :
1/-a : O2 + 4H+ + 4e = 2H2O
CH3CH2OH +H2O = CH3COOH + 4H+ + 4e
b: En faisant la somme des deux demi-équations électroniques précédentes on retrouve l'équation cherchée :
CH3CH2OH + O2 = CH3COOH + H2O
2/ 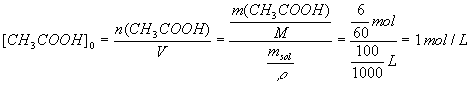
3/-a: CH3COOH + H2O = CH3COO- + H3O+ .
b: [H3O+]eq = Yeq = 10-pH = 10-2,3 = 5.10-3 mol/L
Ymax = 1 mol/L
t=Yeq/Ymax = 5.10-3 << 1 : la transformation est donc très limitée .
4/ Nous venons d'écrire [H3O+] = 5 . 10-3 mol/L
Nous pouvons également écrire : [CH3COO-] = Yeq = 5.10-3 mol/L
[CH3COOH] = 1 - Yeq = 1000. 10-3 - 5. 10-3 = 9,95 . 10-1 mol/L (ce qui est pratiquement égal à 1 mol/L )
5/CC6H5COO- = n/V = (m/M)/V = 1/144 = 6,94.10-3 mol/L
6/-a : couples C6H5COOH/C6H5COO- et CH3COOH/CH3COO-
b : C6H5COO- + H+ = C6H5COOH
CH3COOH = CH3COO- + H+
-----------------------------------------------------------
C6H5COO- + CH3COOH = C6H5COOH + CH3COO- : c'est l'équation demandée .
c :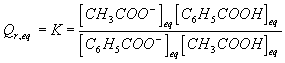
d:
| Equation chimique | C6H5COO-+ CH3COOH---> C6H5COOH + CH3COO- | ||||
| Etat du système | Avancement volumique | Quantités de matière |
|||
| Etat initial | 0 |
6,94.10-3 mol/L |
0,995 mol/L |
0 |
0 |
| Etat final | Yeq |
6,94.10-3-Yeq |
9,95.10-1 -Yeq |
Yeq |
Yeq |
7/ -a: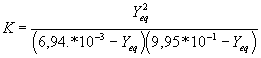
b= cette expression s'écrit aussi 0,251 * (6,9 . 10-3 -1,0016 Yeq + Y2eq ) =Y2eq
d'où en définitive :
0,750 Y2eq +0,251 Yeq -1,73 . 10-3 = 0
Cette équation admet 2 solutions : Yeq,1 = 6,7.10-3 mol/L et Yeq,2= -0,34 .
Seule , la première solution a un sens : Yeq= 6,7 . 10-3 mol/L
c: Finalement , si l'on tient compte du conservateur , nous obtenons :
[CH3COOH]final = 9,95 . 10-1 - 6,7 .10-3 = 0,988 mol/L . Il est clair que l'ajout de conservateur ne modifie pas notablement la concentration en acide éthanoïque du vinaigre .