
DEVOIR SURVEILLE DE PHYSIQUE-CHIMIE - TS7 (30/9/04)
I/Condensateur d'un flash (10 points)
On se propose d'étudier le fonctionnement d'un flash d'appareil photographique jetable. Pour obtenir un éclair de puissance lumineuse suffisante, on utilise un tube flash qui nécessite, pour son amorçage, une forte tension (au moins 250 V) pour émettre un éclair très bref. Pour stocker l'énergie électrique nécessaire au fonctionnement du tube flash, on utilise un condensateur de capacité C .Ce condensateur est chargé à l'aide d'un circuit électronique alimenté par une pile. On schématise le fonctionnement de ce dispositif sur le schéma ci-dessous :

•l'alimentation est assurée par une pile de tension continue U1 = l ,50 V;
• un circuit électronique permet d'élever la tension Ui à une tension continue U2 = 300 V ;
• un conducteur ohmique de résistance R = l ,00 kW permet la charge du condensateur de capacité C= 150 µF en plaçant l'interrupteur inverseur K1 en position l et en fermant l'interrupteur K ;
• le tube flash est déclenché (une fois le condensateur chargé) en basculant l'interrupteur K2 en position 2.
1-Charge du condensateur :
On charge le condensateur en fermant l'interrupteur K .
a)Donnez l'expression de la constante de temps t en fonction de R et C
b)Vérifier par une analyse dimensionnelle (clairement justifiée) que t est homogène à un temps .
c)Calculer la valeur numérique de t .
d)Calculer l'énergie Econdensateur emmagasinée par le condensateur de capacité C une fois la charge terminée à la tension U2 .
e)En calculant l'énergie E" qu'aurait stockée le condensateur s'il avait été chargé directement à l'aide de la pile (tension U1), justifier l'intérêt de charger le condensateur avec une haute tension de 300 V
2-Décharge :
En plaçant l'interrupteur inverseur K2 sur la position 2 on provoque le flash grâce à l'énergie stockée dans le condensateur. On enregistre la tension u aux bornes du condensateur C (graphique ci-dessous) .
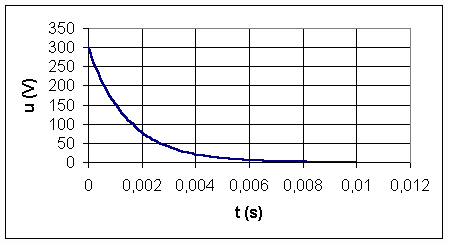
a)Comparaison entre temps de charge et temps de décharge
1-Déterminer graphiquement à partir de la courbe , la constante de temps t' correspondant à la décharge en précisant la méthode employée (faites un schéma sur votre copie).
2- Comparer les constantes de charge t et de décharge t'. Ce constat est il en accord avec les conditions de fonctionnement d'un tube flash ?
b)On assimilera, après son amorçage, le tube flash à un conducteur ohmique de résistance r .En utilisant les notations du schéma ci-contre :
1-Donnez la relation entre i et q ainsi que la relation entre u et q
2-Que peut-on dire de u et ur ?
3-Enoncez la loi d'Ohm (qui relie ur, r et i ) aux bornes du flash .
4-Montrer que l'équation différentielle de la décharge du condensateur à travers un conducteur ohmique de résistance r est de la forme :
c) La fonction ![]() est solution de l'équation différentielle
. Que représente la tension U0 pour le
fonctionnement du tube flash ? Quelle est sa valeur ? (on rappelle que e0=1)
est solution de l'équation différentielle
. Que représente la tension U0 pour le
fonctionnement du tube flash ? Quelle est sa valeur ? (on rappelle que e0=1)
II/Etude d'un facteur cinétique : (10 points)
L'objet des manipulations qui suivent est l'étude de l'influence d'un facteur cinétique de l'oxydation des ions iodure I- par les ions peroxodisulfate S2O82- suivant l'équation :
S2O82- +2I- -----> 2SO42- + I2 (1)
Cette transformation lente produit du diiode dont la présence sera détectée par la coloration bleue de l'empois d'amidon servant d'indicateur .
Dans le milieu réactionnel , en plus des ions précités, existent en quantité continue et limitée, des ions thiosulfate S2O32- qui réagissent avec le diiode au fur et à mesure de sa formation, suivant l'équation :
2S2O32- + I2 -----> S4O62- + 2I- (2)
La transformation associée est totale et très rapide . Elle régénère les ions I- .
On réalise l'expérience suivante : Dans un bécher , on verse :
*un volume V1=1,00 mL d'une solution aqueuse de thiosulfate de potassium (T), de concentration de soluté apporté CT= 1,00 mol.L-1;
*deux gouttes d'empoi d'amidon
*une solution aqueuse d'ions iodure de potassium(apportant des ions iodure en excès) pour obtenir en tout 160 mL de solution.
A la date t=0 , on ajoute 40,0 mL de solution de peroxodisulfate de potassium de concentration égale à 1,00 . 10-1 mol.L-1. Le volume de solution totale est alors de 200 mL.
A la date t1=52 s, l'empos d'amidon se colore en bleu .
Instantanément , on ajoute à nouveau un volume V1=1,00 mL de solution T.La coloration bleue disparaît tout d'abord et réapparaît à la date t2=115 s.
La température reste constante pendant toute la durée de la manipulation .
1/Etablir les demi-équations électroniques relatives aux deux couples rédox concernés (I2/I-) et (S2O82-/SO42-) et retrouver l'équation (1)
2/Dans le cas général , citez les facteurs cinétiques d'une transformation chimique .
3/En utilisant les équations (1) et (2) , répondre aux questions a et b qui suivent sans faire de calcul :
a-Dans l'expérience citée, on veut étudier l'influence d'un seul des facteurs cinétiques: la concentration en ions peroxodisulfate. En analysant le mode opératoire, expliquer comment on élimine l'influence des autres facteurs .
b-Alors que la réaction (1) démarre à t=0, pourquoi la teinte bleue ne se manifeste qu'à la date t1 ?
4/La courbe donnée ci-après représente la concentration molaire en ions peroxodisulfate en fonction du temps .
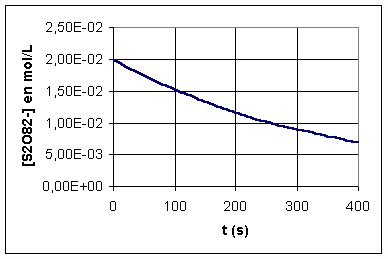
a-Retrouver à l'aide des données numériques de l'énoncé, la valeur de la concentration molaire de S2O82- à l'instant t1 indiqué sur le graphe .
b-Exprimer la vitesse de disparition Vd des ions peroxodisulfate .
c-Exprimer la vitesse de réaction en fonction de [S2O82-] et ensuite en fonction de Vd .
d-Déterminer cette vitesse aux instants t=0 et t=t2 . Comparer les valeurs obtenues .
e- Quel facteur cinétique explique cette variation de vitesse de réaction ?
T DS1 2004/2005 - Correction :
I/Condensateur :
1-Charge :
a : t=RC
b : [t] = W*F avec W=V/A car R=U/i (loi d'Ohm pour un conducteur ohmique) et F=C/V car C=q/u
De plus C=A*s car q=I*t
Finalement : {t]= (V/A)*(A*s/V) = s
t a donc la dimension d'un temps .
c:t = 1000*150.10-6= 0,15 s
d: Econdensateur = 1/2*C*U22 = 0,5*150.10-6*3002 =6,75 J
e: E"=0,5*150.10-6*1,52 =1,7.10-4 J . Il est clair que E"<<Econdensateur .
Autrement dit , un condensateur chargé sous haute tension emmagasine davantage d'énergie électrique .
2-Décharge :
a-1 : t' est l'abscisse du point d'intersection de la tangente à la courbe à t=0 avec l'axe des abscisses : t'= 0,002 s
2- t>>t' : ce résultat est en accord avec le fonctionnement d'un flach dont l'éclair doit être bref .
b-1 : i=dq/dt et q= Cu
2: u et ur sont égales (u=ur)
3: ur=-r*i
4: u=ur ou u=-r*i=-rdq/dt =-rCdu/dt et finalement u+rcdu/dt = 0 c.q.f.d.
c:U0 est la valeur de u à t=0 . D'après le graphe U0=300 V
II/Facteur cinétique :
1-2I- = I2 + 2e
S2O82- + 2e = 2SO42-
---------------------------------------
2I- + S2O82- ----> I2 + 2SO42-
2-Les facteurs cinétiques sont en général la concentration des réactifs et la température .
3-a: * influence de T : on travaille à température constante
* Les ions I- étant régénérés par la réaction (2) , leur concentration est constante dans le milieu réactionnel .
Par conséquent , seule la concentration des ions peroxodisulfate influence la vitesse de la réaction (1) .
b: la réaction (1) débute à t=0 et de ce fait du diiode se forme dans le milieu réactionnel . Mais la réaction (2) qui est rapide les transforme immédiatement en ions iodures , si bien qu' en l'absence de I2 la teinte bleue de l'amidon ne se manifeste pas . La teinte bleue n'apparaîtra en fait que lorsqu'il n'y aura plus d'ion thiosulfate dans le mileu réactionnel pour réagir avec le diiode formé par la réaction (1)
4-a :Sur le graphe , nous lisons [S2O82-]= 1,75.10-2 mol.L-1.
Le diiode formé entre l'instant t=0 et t=t1 réagit avec le volume V1 de la solution de thiosulfate initialement introduit dans le mélange réactionnel avec les ions iodure et les ions peroxodisulfate .
*D'après la réaction (2) , nous pouvons écrire (on peut aussi utiliser un tableau d'avancement) :
n(I2 formé par la réaction (1) entre t=0 et t=t1) = n(I2 ayant réagi avec S2O32-) [la réaction (2) est rapide]
Sachant que : n(I2 ayant réagi avec S2O32-) = n(S2O32- ayant réagi)/2 , nous avons donc :
n(I2 formé par la réaction (1) entre t=0 et t=t1) = n(S2O32- ayant réagi)/2
*D'après la réaction (1) , nous pouvons de plus écrire :
n(I2 formé par la réaction (1) entre t=0 et t=t1) =n(S2O82- ayant réagi)
avec n(S2O82- ayant réagi) = n(S2O82- initial) - n(S2O82- restant à t=t1)
et finalement , la concentration des ions peroxodisulfate à l'instant t=t1 dans le mélange est telle que :[S2O82-]t=t1 = n(S2O82- restant à t=t1)/Vsolution = [n(S2O82- initial) -n(S2O32- ayant réagi)/2 ]/Vsolution
AN : S2O82-]t=t1 = [40.10-3*0,1-1.10-3/2]/200.10-3 = 1,75.10-2 mol.L-1
ce qui correspond bien à la valeur lue sur le graphique .
b: Vd = -d[S2O82-]/dt
c: Pour la réaction (1) , l'avancement x(t) est tel que :
n(S2O82- restant à t) =
n(S2O82- initial) - x(t)
et donc ![]() en ayant posé pour alléger l'écriture n=n(S2O82- restant à t)
en ayant posé pour alléger l'écriture n=n(S2O82- restant à t)
Or la définition de la vitesse de réaction est : ![]() , et
tenant compte de ce qui précède :
, et
tenant compte de ce qui précède :
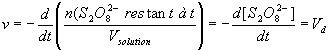
d:On détermine les coefficients directeurs des tangentes à la courbe aux instants considérés. La vitesse de réaction est égale , d'après ce qui précède à l'opposé du coefficient directeur de la tangente à l'instant considéré .
Les détails des tracés et des calculs doivent apparaître sur la copie
* à t=0 V= 50.10-6 mol.L-1.s-1
*à t= 115 s V= 40.10-6 mol.L-1s-1
e:Le facteur cinétique responsable de la variation de la vitesse de la réaction au cours du temps est la concentration des ions S2O82- qui diminue .