DEVOIR SURVEILLE DE PHYSIQUE- CHIMIE TS10 (11/10/02)
I/Etude cinétique de la réaction de l'eau oxygéné avec les ions iodure (10 points)
On veut réaliser la cinétique d'une réaction lente entre les ions iodure I
- et le peroxyde d'hydrogène H2O2 .La concentration de diiode formée est déterminée par spectrophotométrie.
On réalise successivement les trois mélanges ci-dessous (pour chacun des trois mélanges , l'eau oxygéné est introduite à l'instant t=0 s); dans les trois mélanges , l'acide sulfurique est en large excès .
Acide sulfurique 0,1 mol/L |
Solution I - 0,1 mol/L |
Eau oxygénée 0,1 mol/L |
Eau distillée |
|
Mélange A |
10 mL |
18 mL |
2 mL |
- |
Mélange B |
10 mL |
10 mL |
2 mL |
8 mL |
Mélange C |
10 mL |
10 mL |
1 mL |
9 mL |
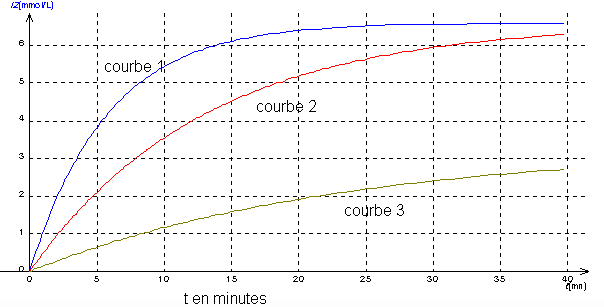
Le document ci-dessous donne les concentrations en diiode formé en millimole par litre en fonction du temps . L'équation de la réaction étudiée est :
H
2O2 + 2H+ + 2I- -----> 2H2O + I2
1-Etude de l'état initial :
a)Calculer en millimole , les quantité initiales en peroxyde d'hydrogène et en ions iodure, pour chaque mélange .
b)Préciser (en justifiant) dans chaque cas le réactif limitant .
2-Etude des courbes :
a)Calculer pour chaque mélange, les concentrations finales en diiode lorsque la réaction est terminée .
b)Attribuer à chaque courbe numérotée le mélange correspondant A, B ou C en justifiant .
c)A t= 30 mn , les réactions sont-elles terminées dans les trois cas ? Justifiez la réponse .
3-Détermination des vitesses de réaction :
a)Définir la vitesse de formation V
f(I2) du diiode .b)Exprimer l'avancement X de la réaction à l'instant t en fonction de la quantité de diiode n(I
2) formée à l'instant t .c)On suppose que le volume du système chimique V
système est constant . Définir la vitesse de la réaction VR en fonction de X et Vsystème . En déduire une relation simple entre Vf(I2) et VR .d)Calculer pour la courbe 2 , la vitesse de la réaction en mmol.L
-1.min-1 à t= 5 min , puis lorsque t=15 min . On précisera la méthode utilisée .e)Comparer les deux vitesses précédentes et indiquer le facteur cinétique responsable de la variation de la vitesse de réaction au cours du temps .
4-Temps de demi-réaction :
Déterminer le temps de demi-réaction pour la courbe 1 (détaillez la méthode utilisée)
5-Rôle de l'acide sulfurique :
a)Dans cette réaction , l'acide sulfurique peut-il être considéré comme un réactif ?
b)Expliquer comment on pourrait, expérimentalement, étudier l'influence de la concentration en acide sulfurique sur la vitesse de réaction .
II/Condensateur : (10 points)
On condensateur de capacité C,initialement chargé sous une tension U= 5 V, est déchargé à travers un conducteur ohmique de résistance R=100 k
W .On mesure la tension Uc aux bornes du condensateur au cours de la décharge et , d'après ces mesures, on obtient la courbe ci-dessous figure 1 (l'axe horizontal est gradué en secondes):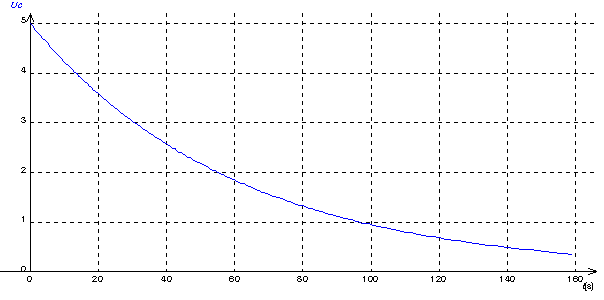
figure 1
a)Quels sont les deux montages parmi ceux représentés ci-dessous ,figure 2, qui permettent de réaliser la charge et la décharge du condensateur ?
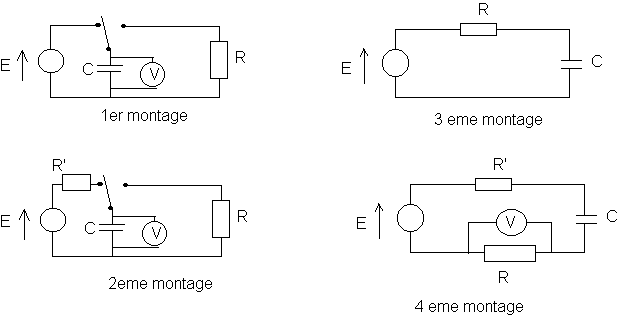
figure 2
b)Pour lequel de ces deux montages la charge est-elle la plus rapide ? Justifiez la réponse .
c)En notant U
c la valeur instantanée de la tension aux bornes du condensateur, montrer que l'équation différentielle du circuit de décharge est de la forme :![]()
On définira clairement sur un schéma les différentes grandeurs utilisées
d)Vérifier que ![]() est
solution de l'équation précédente .
est
solution de l'équation précédente .
e)Déduire du graphe U
C(t) la valeur de Um en admettant que la charge initiale du condensateur est maximale .f)Montrer que la constante de temps
t = RC du circuit est homogène à un temps.g)Déduire de la courbe la valeur de la constante de temps
t .h)Calculer l'ordre de grandeur de la capacité C du condensateur.
i)Quelle était l'énergie emmagasinée par le condensateur juste avant la décharge ?
CORRECTION :
I/Etude cinétique de la réaction de l'eau oxygéné avec les ions iodure
1-a: n0(I-) = CI- * V0
Le tableau ci-dessous récapitule les quantité initiales en peroxyde d'hydrogène et en ions iodure pour chacun des trois mélanges :
ions I- |
Eau oxygénée |
|
Mélange A |
1,8 mmol |
0,2 mmol |
Mélange B |
1 mmol |
0,2 mmol |
Mélange C |
1 mmolL |
0,1 mmol |
b)Dans chaque cas n0(I-)/2 > n0(H2O2) : le réactif limitant est par conséquent l'eau oxygéné H2O2 .
2-a :La limite est imposée par le réactif limitant . D'après l'équation de la réaction nfinal(I2) = n0(H2O2) (lorsque une mole de H2O2 réagit , il se forme une mole de I2) . Or [I2]final = nfinal(I2)/Vsystème avec Vsystème = 30 mL . D'où le tableau suivant :
[I2]final |
|
Mélange A |
6,6 mmol/L |
Mélange B |
6,6 mmol/L |
Mélange C |
3,3 mmol/L |
b:La courbe 3 correspond au mélange C : c'est celui pour lequel la concentration finale en diiode est la plus faible (limite 3,3 mmol/L)
La courbe 1 correspond au mélange A : c'est pour cette courbe que la limite [I2]final = 6,6 mmol/L est la plus rapidement atteinte , ce qui s'explique par le fait que dans ce mélange les concentrations initiales des réactifs sont lplus élevées que dans le mélange B.
La courbe 2 correspond au mélange B
c:A t= 30 mn , la réaction est terminée uniquement pour le mélange 1 : la limite [I2]final = 6,6 mmol/L est en effet atteinte.
Les limites correspondantes pour les deux autres mélanges ne sont pas atteintes .
3-a: ![]()
b:D'après l'équation de la réaction X = n(I2)
c: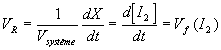
d: A t= 5 mn VR = 0,35 mmol/min
A t= 15 mn VR= 0,160 mmol/min
On trace les tangentes aux instants considérés à la courbe 2 : Le coefficient directeur de la tangente est égal à la vitesse de réaction (justificatif : c).
e: Ainsi la vitesse de réaction est plus élevée à t= 5 min qu'à t=15 mn : cela s'explique par le fait que la concentration des réactifs diminue au cours du temps .Le facteur cinétique à prendre en compte est par conséquent la concentration des réactifs .
4:Lorsque la réaction est terminée [I2]final = 6,66 mmol/L. La durée pour laquelle la concentration en diiode est égale à la moitié de sa valeur finale , soit ici 3,33 mmol/l ,est appelée "temps de demi-réaction" . Sur la courbe 1 , on lit t1/2 = 4 mn .
5:a-L'acide sulfurique , "représenté" par les ions H+ dans l'équation de la réaction intervient dans la réaction :il peut donc être considéré comme un réactif .
b-Pour étudier l'influence de la concentration en acide sulfurique sur la vitesse de réaction , il suffit d'envisager un quatrième mélange où la quantité d'acide sulfurique serait différente de celle des trois autres mélanges . On étudie ensuite l'évolution au cours du temps de [I2].
Par exemple , on peut mélanger 15 mL d'acide sulfurique , 10 mL de I- , 2 mL de H2O2 , 3 mL d'eau distillée et comparer la courbe obtenue avec celle du mélange B (courbe 2).
II/Condensateur :
a)Le premier montage et le second montage permettent d'étudier la charge et la décharge d'un condensateur . Suivant le cas , le commutateur à 2 positions est basculé dans une position ou dans une autre .
b)Une charge est d'autant plus rapide que la constante de temps t =R'C est faible .La charge est plus rapide pour le montage 1 , car la résistance du circuit de charge se réduit à la résistance des fils de connexion et elle est donc faible comparativement à celle du circuit de charge de la figure 2 (résistance R').
c)
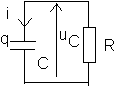
Avec les notations adoptées sur le schéma ci-contre , nous avons :
![]()
et par conséquent :
![]()
ou finalement
![]()
d)
En utilisant la solution proposée , nous obtenons :
![]()
et donc :
![]()
Autrement dit , la solution proposée vérifie bien l'équation différentielle .
e)A t=0 , nous avons Uc=Um puisque e0=1 . Nous pouvons donc lire directement Um sur la courbe de la figure 1 (valeur de uC à t=0) . Nous lisons Um= 5 V
f)[t] = [R]*[C]
Or [R] = V/A puisque R=u/i
[C] = C/V puisque q=C/u
et donc [t]= C/A
Or C/A = s puisque i=dq/dt (A=C/s)
t est donc bien homogène à un temps .
g)La tangente à uC(t) à t =0 coupe l'axe des abscisses à t=t . La construction graphique de la tangente donne t= 60 s .
h)
C=t/R = 60/100 103 = 60 10-5 = 600 10-6 = 600 µF
i)Ee= 1/2 CUm2 = 7,5 10-3 J = 7,5 mJ