Spe SPC - Colles et adhésifs
I/Définitions
Lorsqu’on veut fixer deux surfaces l’une par rapport à l’autre, on place entre elles une substance liquide ou pâteuse, en couche mince, qui en « séchant » forme un lien généralement très solide et définitif.
Les colles sont caractérisées par le fait qu’elles se solidifient après application, tandis que les adhésifs sont des matériaux solides mous qui n’évoluent pas une fois appliqués. Dans les deux cas, il s’agit d’un matériau intercalaire qui assure un contact intime avec la surface de chacun des deux matériaux que l’on souhaite faire adhérer en dépit de leur rugosité de surface. Pour cela, les colles sont liquides tandis que les adhésifs se déforment.
Dans la littérature, on donne parfois, à cette substance, le nom d’adhésif si elle est synthétique et de colle si elle est naturelle.
Dans le cours qui suit nous utiliserons exclusivement le terme d’adhésif, étant entendu que ce qui sera écrit sera aussi valable pour les colles.
Remarque
– Il existe des cas où on ne souhaite pas que le collage soit définitif («post-it» par exemple) mais au contraire qu’il permette la séparation facile des surfaces et une adhérence renouvelée à chaque contact.
– Il existe des cas où le collage peut se faire directement entre les deux surfaces sans qu’on ait besoin de mettre d’interface c’est à dire d’adhésif : c’est le cas des collages moléculaires.
II/Mécanisme du collage - Conditions d’un bon collage
a. Mécanisme du collage
Lorsqu’on souhaite tracter une voiture en panne au moyen d’un autre véhicule, détailler tout ce qu’il faut faire.
b. La chimie du collage
***L’adhésif doit se fixer solidement sur les surfaces :
Comme les vernis, peintures, teintures et encres qui doivent « s’accrocher » au support, les molécules d’adhésif doivent former avec les molécules du support des liaisons fortes (covalentes ou ioniques) ; elles peuvent aussi former des liaisons de plus faible énergie (liaisons hydrogène par exemple) qui, si elles sont seules à s’exercer, doivent être en plus grand nombre pour permettre une fixation suffisante.
***L’adhésif doit se rigidifier :
Tous les adhésifs sont des polymères.
Certains ont déjà leur structure et sont dans un solvant approprié (eau ou solvant organique) : ils deviennent rigides par évaporation du solvant. D’autres sont à l’état de monomère et ils deviennent rigides en se polymérisant.
Pour d’autres encore, qui se présentent en deux parties, ce n’est qu’en mélangeant ces deux parties que la polymérisation a lieu.
Exemple : Un exemple de collage à liaison covalente :
Lorsqu’on colle deux plaques de verre par des adhésifs à base de silanols par exemple, des liaisons Si-O-Si se forment. L’énergie d’adhérence est grande : c’est un collage efficace.
On représente ainsi la plaque de verre:

L’adhésif en présence d’humidité donne un silanol :
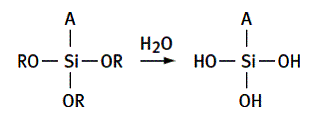
A pouvant être un groupe hydroxyle, amine ou autre.
Le collage se déroule comme suit :
***Le verre adsorbe l’adhésif : des liaisons hydrogène s’établissent entre le verre et l’adhésif.
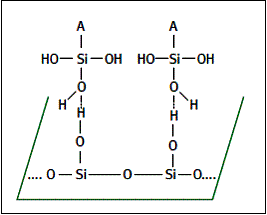
***Des liaisons hydrogène s’établissent à l’intérieur de l’adhésif.

***Une polymérisation par condensation se produit (élimination de molécules d’eau) et des liaisons covalentes
s’établissent :
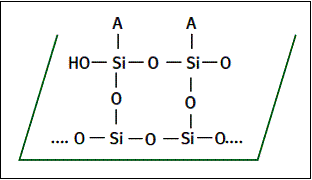
Une deuxième surface de verre située au dessus (dans ce schéma) serait traitée dans des conditions identiques. Une réticulation à base de liaisons Si-O-Si assure la cohésion de l’ensemble d’où la solidité recherchée.
c)Considérations physiques lors d’un collage
***Il est capital que les liaisons entre adhésif et support soient résistantes, encore faut-il qu’elles puissent s’établir c’est-à-dire qu’il y ait un bon contact entre l’adhésif et les surfaces à coller.
L’adhésif doit pouvoir s’étaler sur le support, on dit qu’il doit pouvoir mouiller la surface sur laquelle on l’applique ; cela met en jeu une notion de physique : la tension superficielle.
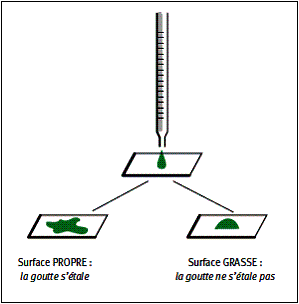
Versons une goutte d’eau sur une surface lisse ; on peut observer deux phénomènes différents selon l’état
de propreté de la surface :
La présence d’un film gras, de poussières ou de salissures diverses, augmente la tension superficielle et empêche la goutte d’eau de s’étaler ;
au contraire un tensio-actif diminue la tension superficielle et permet cet étalement, on dit que le liquide mouille mieux la surface.
Pour améliorer le contact entre adhésif et support on a donc intérêt à avoir un support propre et notamment dégraissé.
***Les micro-cavités présentes à la surface du support seront aussi un facteur favorable au collage ; elles doivent pouvoir recevoir l’adhésif (qui doit être suffisamment fluide) et seront des points d’ancrage de l’adhésif sur le support.
Parfois on passe un agent abrasif à la surface des supports lisses pour multiplier ces micro-cavités :

d. Les conditions d’un bon collage
En rassemblant ce qui vient d’être dit on résume les conditions d’un bon collage :
– Il convient d’adapter la nature chimique de l’adhésif à celle du support pour qu’il s’établisse des liaisons chimiques si possible de forte énergie.
– Il convient de nettoyer parfaitement les surfaces à coller pour agir sur la tension superficielle (en la diminuant) et pour permettre à l’adhésif de s’étaler sur le support.
– Les micro-cavités des surfaces à coller sont intéressantes comme points d’ancrage de l’adhésif ; on peut donc au besoin les créer avec un agent abrasif.
III/Le collage moléculaire
C’est une technique qui est apparue dans les années 1980 en microélectronique.
Elle permet par exemple de coller deux plaques de silicium ou deux plaques de silicium oxydées en surface, sans faire appel à un produit spécifique intermédiaire.
On rapproche le plus possible les deux plaques c’est-à-dire qu’on les rend suffisamment lisses pour que les atomes de l’une soient à une distance de l’ordre de quelques nanomètres des atomes de l’autre ; les forces attractives entre les deux structures sont alors assez élevées pour provoquer l’adhérence moléculaire ; ce sont des forces de Van der Waals qui, on le sait, sont d’autant plus importantes que la distance entre les surfaces est faible. Dans beaucoup d’applications ces collages moléculaires sont réalisés à température et pression ordinaires après un nettoyage chimique des surfaces.
Si on veut renforcer les énergies de collage (c’est-à-dire rendre le collage plus résistant) on peut mettre en oeuvre un traitement thermique ; plus les températures seront hautes et plus les énergies de collage seront importantes.
Au-delà d’une certaine température (qui dépend de la nature hydrophile ou hydrophobe de la surface et du nettoyage de celle-ci), la majorité des liaisons entre les deux surfaces sera des liaisons covalentes.
Deux exemples :
– Le collage de deux plaques de silicium dont les surfaces sont hydrophobes pourra par exemple être suivi d’un traitement thermique a 600°C. Il en résultera des liaisons covalentes Si-Si
– Le collage de deux plaques de silicium oxydées dont les surfaces sont hydrophiles mettra en jeu a 150°C des liaisons hydrogènes (avec les monocouches moléculaires d’eau adsorbée a leur surface) plus "résistantes" que les forces de Van der Waals. Chauffées vers 700°C il se formera des liaisons Si-O-Si covalentes.
La création de structures SOI (Silicium sur isolant) pour la réalisation de circuits intégrés, s’appuie largement sur le collage par adhérence moléculaire.
IV/Coller une matière anti-adhésive
Le téflon (ou PTFE) est thermostable (fusion a 327°C) et lorsqu’il constitue le revêtement anti-adhésif d’un ustensile de cuisine le fabricant conseille une utilisation de l’ustensile jusqu’a environ 250°C ; il est chimiquement inerte et anti-adhésif donc ayant un coefficient de frottement très faible, ce qui s’explique, chimiquement parlant, par le fait que sa longue barrière d’atomes de fluor l’isole et qu’il refuse toute alliance avec l’extérieur.
Pour fixer le téflon sur un métal on peut envisager deux méthodes :
***Première méthode : un sablage de la surface métallique qui la rend rugueuse ; une première couche de téflon s’agrippe grâce aux aspérités ; une deuxième couche de téflon rend la surface propre a la cuisson, sans matière grasse et sans accrocher.
***Deuxième méthode : une première couche d’un polymère P adhère au métal ; on applique une deuxième couche d’un polymère qui a autant d’affinité que possible avec le polymère P et le téflon ; enfin on applique une troisième couche faite de téflon.
V/Des matières qui ne peuvent pas se coller
Les produits actuels permettent des collages de deux matières éventuellement très différentes l’une de l’autre. Comme colles polyvalentes et d’une grande efficacité on peut citer sans doute les cyano-acryliques et les "epoxy".
Pourtant, polyéthylène, polypropylène, particulièrement inertes, refusent de fixer les colles même réputées les plus performantes, sauf par addition d’un activateur
spécifiques.
VI/Conclusion :
Lorsqu’on veut fixer deux surfaces l’une par rapport à l’autre, on place entre elles une substance liquide ou pâteuse, en couche mince, qui en «séchant» forme un lien généralement très solide et définitif.
Les colles sont caractérisées par le fait qu’elles se solidifient après application, tandis que les adhésifs sont des matériaux solides mous qui n’évoluent pas une fois appliqués. Dans les deux cas, il s’agit d’un matériau intercalaire qui assure un contact intime avec la surface de chacun des deux matériaux que l’on souhaite faire adhérer en dépit de leur rugosité de surface.
Pour cela, les colles sont liquides tandis que les adhésifs se déforment.
Comme il y a de plus en plus de matériaux nouveaux que l’on souhaite coller entre eux, il existe un nombre très importants de colles dans les magasins de bricolage : on peut aujourd’hui presque tout coller…alors même que la théorie de l’adhésion n’est pas encore complètement aboutie !