Spe SPC - Structures et propriétés des matériaux
I/Les émulsions
a. Qu’est-ce qu’une émulsion ?
Verser dans un verre un peu d’eau et ajouter ensuite un peu d’huile. Il est facile de voir que les deux liquides ne se mélangent pas et qu’ils forment deux phases distinctes : l’eau, incolore, constitue la phase inférieure et l’huile,
jaune, constitue la phase supérieure de ce mélange hétérogène.
Mélangeons énergiquement le contenu du verre en l’agitant avec une cuillère à café ; on constate que des gouttes d’huile pénètrent dans l’eau et que des gouttes d’eau pénètrent dans l’huile. On a ainsi obtenu une émulsion ; mais si on laisse reposer le contenu du verre quelques instants, l’huile et l’eau se séparent et on retrouve nos deux phases bien distinctes.
On peut dire que l’huile et l’eau forment une émulsion instable.
Une émulsion est une dispersion de gouttelettes d’un liquide dans un autre liquide, non miscible avec le premier.
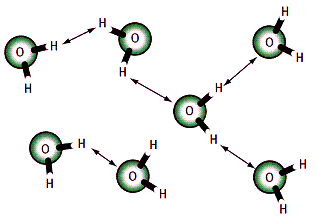
Pourquoi l’huile et l’eau ne veulent-elles pas cohabiter dans une même phase ? Pour le comprendre, il faut analyser la nature chimique de ces deux substances. On a représenté ci-dessus des molécules d’eau et les flèches symbolisent les liaisons particulières qui se créent entre les atomes d’hydrogène et d’oxygène (liaisons hydrogène).
Verser dans un verre un peu d’eau et ajouter ensuite un peu d’huile. Il est facile de voir que les deux liquides ne se mélangent pas et qu’ils forment deux phases distinctes : l’eau, incolore, constitue la phase inférieure et l’huile, jaune, constitue la phase supérieure de ce mélange hétérogène.
Quand l’eau se trouve à l’état liquide, les molécules d’eau sont au contact les unes des autres. L’atome d’oxygène d’une molécule a alors tendance à attirer l’atome d’hydrogène d’une autre molécule et à créer ainsi des liaisons hydrogène (symbolisées par des flèches sur le dessin) car ce type de liaison n’existe qu’entre l’atome d’hydrogène et des atomes qui ont tendance à attirer les électrons comme l’atome d’oxygène.
Les corps, qui possèdent des molécules assez petites renfermant des atomes qui ont tendance à attirer les électrons pour former aussi des liaisons hydrogène, seront solubles dans l’eau : par exemple, l’éthanol (CH3 - CH2 - OH) est très soluble dans l’eau. Par contre, les corps qui possèdent de très grosses molécules ne seront pas solubles dans l’eau : c’est le cas des huiles et de tous les corps gras.
Par exemple, la mayonnaise est une émulsion de gouttelettes d’huile dans l’eau.
b. Comment expliquer que l’huile et l’eau donnent une émulsion stable dans la mayonnaise ?
Nous avons dit que lorsqu’on prépare une vinaigrette, par exemple, on peut obtenir un mélange momentané des deux liquides ce que l’on a appelé une émulsion, mais si on laisse reposer la vinaigrette assez longtemps, le vinaigre (phase aqueuse) et l’huile (phase organique) se séparent. On dit que la vinaigrette constitue une émulsion instable.
Dans la mayonnaise, on mélange également des lipides et de l’eau : on réalise donc une émulsion mais, même après 24 heures, le mélange persiste. On dit que la mayonnaise constitue une émulsion stable.
Le jaune d’oeuf est un mélange de lipides et d’eau, mais il renferme aussi une autre espèce chimique que l’on désigne sous le nom de lécithine qui est aussi, comme les huiles végétales, un triester du glycérol (RCO-O-CH2(OCOR)-O-COR’) mais constitué de deux acides gras (R-CO-OH) et d’un troisième acide (R’-COOH) de nature très différente. De ce fait, une lécithine se présente de la manière suivante : une tête hydrophile (R’-CO-OH) et 2 queues hydrophobes (R-CO-OH).

Il faut noter que la moutarde contient aussi des lécithines et c’est pour cela qu’il faut introduire une quantité suffisante de moutarde au départ, si l’on veut réussir la mayonnaise.
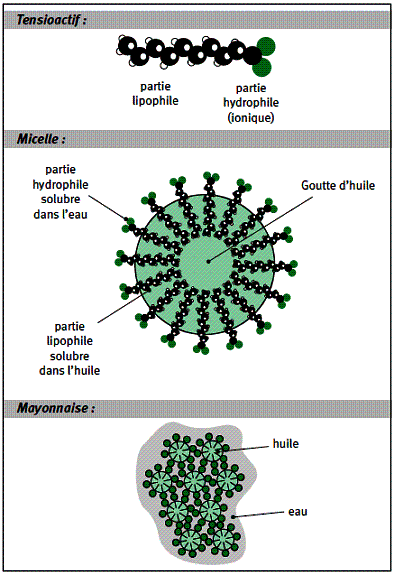
Grâce à leur double nature, tête hydrophile et queue hydrophobe, les lécithines sont des molécules tensioactives qui vont pouvoir réunir deux substances qui en général refusent de rester mélangées : l’eau et les lipides.
Comment fonctionne une espèce tensioactive ?
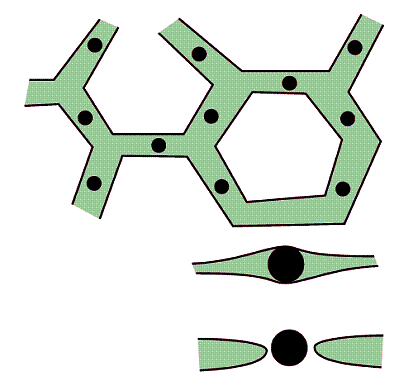
Les queues hydrophobes sont lipophiles, c’est à dire qu’elles aiment les lipides. Elles vont s’accrocher à plusieurs sur une gouttelette d’huile pour former un petit agrégat, comme le montre le schéma ci-contre, que l’on appelle une micelle. Les têtes hydrophiles sont lipophobes c’est à dire qu’elles vont s’éloigner le plus possible de la gouttelette d’huile, mais au contraire elles vont s’accrocher aux molécules d’eau. Grâce aux micelles,
les gouttelettes d’huile sont donc solidement liées aux molécules d’eau qui les entourent. Une fois formées, les micelles se dispersent dans l’eau car les têtes des lécithines portent une charge électrique ; toutes les micelles apparaissent donc comme des entités qui portent toutes des charges de même signe et, en conséquence, elles se repoussent.

Mayonnaise au microscope
Voici 3 observations d’une mayonnaise au bout de respectivement 1, 3 et 5 minutes de battement au fouet.
c. D’autres émulsions
Comme la mayonnaise, la plupart des émulsions sont constituées de gouttelettes d’un liquide dispersées dans un autre liquide. Ce mélange de deux liquides non miscibles ne sera classe dans la catégorie des émulsions que s’il est stable, c’est à-dire si les deux liquides ne se séparent pas « rapidement » pour redonner deux phases distinctes.
Dans le cas des émulsions liquide-liquide, il convient de distinguer les émulsions huile/eau (H/E) dans lesquelles les micelles sont des gouttelettes d’huile entourées par des molécules d’eau, des émulsions eau/huile (E/H) ou les micelles sont des gouttelettes d’eau en suspension dans l’huile. Ainsi le lait est une émulsion H/E, alors que le beurre est une émulsion E/H.
Il existe aussi des émulsions liquide/gaz ou les bulles gazeuses sont entourées de liquide. Dans la crème Chantilly, deux émulsions sont réunies : une émulsion liquide-liquide et une émulsion liquide-gaz.
II/Les tensioactifs
a. Définition et propriétés
Les tensioactifs, que l’on appelle aussi agents de surface (le terme anglais étant « surfactants »), sont des substances solubles dans l’eau et ayant la propriété de se concentrer, de s’agréger, aux interfaces entre l’eau et d’autres substances peu solubles dans l’eau, les corps gras notamment. On les rencontre dans de nombreux domaines, comme les huiles moteur, les produits pharmaceutiques, les savons ou les détergents.
Ces molécules présentent au moins deux parties d’affinité différente :
– l’une est hydrophile (affinité pour l’eau),
– l’autre est lipophile (affinité pour les graisses).
De telles substances sont dites amphiphiles (du grec amphi, « des deux côtés », et « philos », ami).
La partie lipophile est généralement constituée d’une chaîne carbonée assez longue, et qui doit être linéaire (donc non ramifiée) pour être biodégradable.
La partie hydrophile est une extrémité généralement ionique.
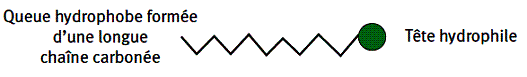
Un tensioactif utilisé en cosmétique peut être schématisé par
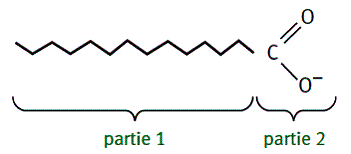
Identifier la partie hydrophile et la partie lipophile de cet ion.
b. Classification
1/ Tensioactif anionique

La partie hydrophile possède une charge négative (anion).
***Les savons : sels d’acides gras : RCOO−,Na+ (R : longue chaîne en C12 à C18 le plus souvent) provenant de la saponification des triglycérides (triesters de glycérol et d’acides gras) des huiles végétales.
Exemple Palmitate de sodium : CH3 —(CH2)14 —COO—,Na+
Remarque :
Les savons a ion sodium sont plutôt durs (on les trouve dans les savonnettes), ceux a ion potassium sont plus mous (employés dans les mousse a raser ou comme émulsionnant dans les crèmes).
***Les alkylsulfates : R-O-SO3-, R étant une longue chaîne carbonée : on les appelle aussi syndets (détergents synthétiques).
Exemple :Le dodécyl sulfate d’ammonium ou lauryl sulfate d’ammonium: C12H25 -O-SO3-,NH4+ présent dans les dentifrices, shampooings, produits pour le bain et la douche...
***Les sulfonates : R−SO3−,Na+ ( R : longue chaîne carbonée) sont peu employés en cosmétologie.
Exemple :Le dodécyl benzène sulfonate présent dans de nombreux détergents (Teepol®,...) :
C12H25 - C6H4 - SO3- , Na+
2/Tensioactif cationique

La partie hydrophile possède une charge positive (cation).
***Les sels d’ammonium quaternaire : RR1R2R3N+, allergisants et assez irritants pour les yeux et la peau, ils sont peu employés en cosmétologie où ils sont alors associés à d’autres composés pour atténuer ces effets . Ils ont cependant des propriétés bactéricides intéressantes. Leurs propriétés démêlantes font qu’ils entrent dans la formulation de nombreux après-shampoings.
Exemple : Le bromure de cétyltriméthylammonium (Cétrimide®) : C16H33N+(CH3)3,Br-
3/Tensioactif non-ionique
![]()
La partie hydrophile est neutre mais fortement polaire. Ces produits sont biologiquement sans risques. On les retrouve dans la formulation de nombreux shampoings pour leurs pouvoirs détergents et moussants et dans les émulsions.
***Les sorbates ou esters de sorbitol et d’acides gras. R.
Exemple : monolaurate de sorbitol.
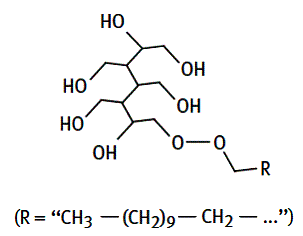
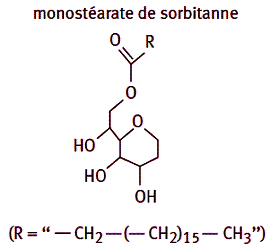
***Les esters de sorbitanne (sorbitanne : C6H12O5) et d’acides gras.
Exemple : Monostéarate de sorbitanne.
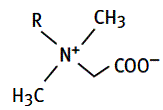
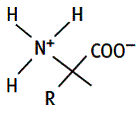
4/Les tensioactifs zwitterioniques ou amphotères
Ils possèdent deux groupements de charges opposées. Suivant le pH, ils sont sous forme cationique ou sous forme anionique. Ce sont d’excellents détergents. Non irritants, ils entrent dans la composition de nombreux shampoings doux, produits pour peau sensible, démaquillants pour les yeux, lotions et gels dermatologiques...
***Les dérivés de bétaïnes :
*** Les acides aminés et leurs dérivés qui sont très utilisés comme co-tensioactifs pour stabiliser les microémulsions en cosmétologie.
c. Propriétés
1/Tension superficielle
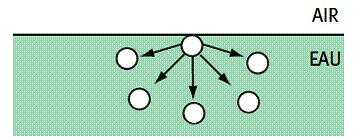
Dans les liquides, les molécules sont en interactions entre elles (forces de Van der Waals).
Au sein du liquide, la résultante des forces appliquées à une molécule est nulle.
Au voisinage de la surface, par contre, apparaît une dissymétrie : la résultante des forces appliquées à une molécule n’est plus nulle et s’exerce vers l’intérieur. La tendance de la surface du liquide est donc de se restreindre.
Pour étirer la surface du liquide, il faut donc appliquer une force et donc fournir de l’énergie. On appelle tension superficielle A , l’énergie W qu’il faut fournir par unité de surface S pour étirer celle-ci , ou la force F par unité de longueur x pour étirer celle-ci.: A=W/S = F/x
A s’exprime en J.m-2 ou en N.m-1
L’ajout d’un produit tensioactif diminue considérablement la tension superficielle de l’eau par la disposition que les molécules prennent dans le liquide :
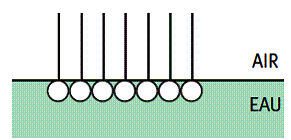
C’est cette disposition qui est à la base des pouvoirs mouillant, moussant et émulsionnant.
2/Pouvoir mouillant
*Eau seule : A élevée : la cohésion du liquide l’emporte sur les interactions avec le solide et le liquide s’étale peu
*Eau + tensioactif : la tension superficielle a baissé moins de cohésion , le liquide s’étale , le mouillage est meilleur

3/Pouvoir détergent
Voir TP : action des savons (savon et tissu)
4/Pouvoir moussant
Les molécules tensioactives renforcent la mince pellicule d’eau qui forme les bulles.

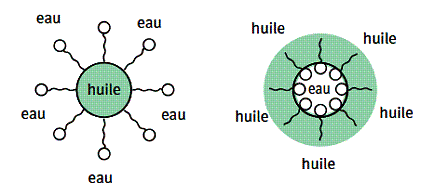
5/Pouvoir émulsionnant
Une émulsion est un système constitué par un liquide se trouvant dispersé sous la forme de fines gouttelettes dans un autre liquide, les 2 liquides étant non miscibles.
On peut avoir des gouttelettes d’huile dans l’eau ou d’eau dans l’huile.
III/Les mousses
Lorsque les enfants prennent un bain, ils adorent jouer dans la mousse : celle-ci est constituée essentiellement d’une multitude de bulles séparées les unes des autres par des parois de film mince d’eau savonneuse.
Comment une mousse stable peut-elle être obtenue ? Au contraire, comment éviter sa formation ? Ces questions sont capitales dans certaines applications. On demande par exemple à une crème à raser de bien mousser, ou à une lessive de lave-linge de ne pas trop en produire.
La stabilité d’une mousse dépend fortement de celle des parois qui sépare les bulles.
a/Constitution d’une mousse
Une mousse est un milieu complexe constitué :
– d’un gaz dispersé dans un liquide : on parle de « mousse liquide ». C’est le cas de la mousse à raser, la mousse du shampooing ou la mousse de la bière.
– d’un gaz dispersé dans un solide : on parle de « mousse solide ». C’est le cas des mousses de polyuréthane, utilisées pour fabriquer des sièges, ou encore les mousses métalliques utilisées dans l’industrie automobile afin de diminuer le poids des véhicules.
Il y a très peu de matière liquide ou solide dans une mousse, mais beaucoup de gaz (souvent de l’air ou du gaz carbonique ), ce qui lui confère une faible densité.
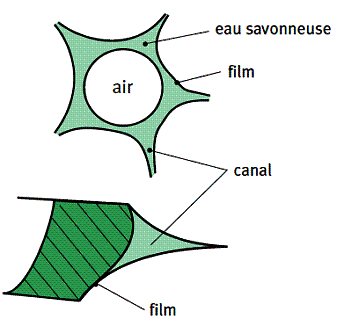
b/Les mousses liquides
Une mousse liquide est constituée de bulles séparées par des films. Une mousse est considérée, dans la majorité des modèles, comme un milieu poreux, constitué d’un réseau de canaux : le liquide circule dans ces canaux, autour des bulles.
1/Comment obtenir une mousse liquide ?
Plusieurs méthodes sont possibles pour disperser un gaz dans un liquide : on peut insuffler le gaz dans le liquide, le fabriquer in situ ou battre le liquide en présence de gaz (battre les blancs d’oeuf « en neige » !), ou encore mélanger un gaz et un liquide en leur faisant traverser un matériau poreux. Dans tous les cas, on ne peut obtenir de mousse dans un liquide pur. En effet, la formation de la mousse et sa durée de vie reposent entièrement sur la présence de certains composés en très faible quantité, dont les principaux sont des tensioactifs. Ces derniers peuvent être naturels ou synthétiques. Ils sont naturellement présents dans le champagne, la bière, le lait, les oeufs, ou au contraire, mélangés préalablement au liquide dans un but précis.
2/Quel est le rôle des composés tensioactifs ?
Ils sont essentiels à la formation et à la stabilisation des films de liquide formés entre les bulles de gaz. Une mousse est constituée de bulles de gaz en contact avec un liquide : on parle plutôt d’interface liquide/gaz. La formation de la mousse augmente nécessairement l’interface liquide/gaz, autrement dit la surface du liquide. Or cette dernière ne peut s’étendre indéfiniment, de même qu’un ressort ne peut être étiré indéfiniment. Cela est dû à l’existence de forces électrostatiques qui s’exercent entre les molécules du liquide et qui lui confère une tension superficielle ou tension de surface.
Plus cette dernière
est élevée, plus il est difficile d’étendre la surface du liquide. La tension
superficielle de l’eau pure est de l’ordre de 72 milliNewton par mètre (mN/m).
Si l’on ajoute un agent susceptible de diminuer la tension superficielle, la
surface de l’eau peut s’étirer et ainsi « accueillir » des bulles : la mousse
pourra se former. À titre
d’exemple, l’ajout d’un composé tensioactif dans l’eau fait chuter la tension
superficielle à 40 voire 30 mN/m. Les tensioactifs des lessives permettent de
laver les salissures mais il n’y a pas de lien direct entre l’efficacité de
lavage et le pouvoir moussant : le rassoul, terre argileuse utilisée au Maghreb
pour laver les cheveux, est un excellent nettoyant qui ne mousse pas. Ce qui
n’empêche pas d’apprécier la mousse d’un shampooing uniquement parce qu’elle
est agréable !
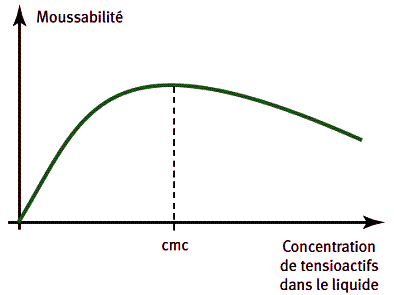
Plongées dans l’eau, ces molécules s’orientent spontanément à l’interface entre air et eau, la partie polaire étant tournée vers l’eau. Le phénomène d’adsorption aux interfaces liquide/air est une propriété fondamentale des composés tensioactifs. Si l’on augmente la quantité de tensioactif, les molécules saturent l’interface eau/air en formant une monocouche de quelques nanomètres d’épaisseur. A l’interface, l’eau est donc remplacée par des molécules tensioactives. En conséquence, les interactions électrostatiques responsables de la tension superficielle changent : la tension superficielle chute et le pouvoir moussant devient maximal. Il est remarquable qu’une couche d’épaisseur aussi fine suffise à modifier de manière aussi sensible les propriétés de l’interface. La formation des couches mono molécu lai res, qui dépend des propriétés d’adsorption des composés tensioactifs aux interfaces liquides/gaz, est primordiale pour la formation d’une mousse. De telles couches ne pourraient se former s’il n’y avait pas d’affinité entre une des extrémités de la molécule tensioactive et l’eau. On ne peut donc former de mousse dans un solvant autre qu’un solvant polaire tel que l’eau.
Le maximum de moussabilité est atteint pour une concentration critique de tensioactif dite « concentration micellaire critique » (cmc) : c’est la concentration à partir de laquelle les molécules tensioactives restées immergées du fait de leur solubilité dans l’eau, se regroupent en amas structurés (micelles) afin de minimiser le contact des chaînes apolaires avec les molécules d’eau environnantes.
3/Les tensioactifs jouent un rôle primordial dans la formation des mousses. Qu’en est-il de la durée de vie des mousses ?
Il faut séparer les notions de formation des mousses et celles de leur stabilité. Une mousse peut se former facilement (cela se mesure par la quantité de mousse formée) et disparaître en quelques instants. La durée de vie d’une mousse peut être très variable : de quelques minutes à quelques heures ou bien jusqu’à quelques jours selon le mode de fabrication et les additifs utilisés (formulation).
Ainsi l’ajout d’un composé co-tensioactif comme le 1-dodécanol en très faible quantité (un pour mille de la quantité de tensioactif utilisé) permet d’augmenter la durée de vie d’une mousse de quelques minutes à plus de 10 heures. Ici on considère que ce composé bien moins soluble dans l’eau que le tensioactif lui- même se place spontanément et entièrement à l’interface air/eau, où il joue le rôle d’un tensioactif agissant de manière significative sur la diminution de la tension superficielle. Un additif peut également contribuer à la stabilité de la mousse en augmentant la viscosité de l’interface. Tout se joue à l’interface liquide/gaz, là où les quantités de matière en jeu sont très faibles. Il n’est donc pas étonnant que quelques modifications de concentrations ou quelques impuretés puissent modifier la formation et la stabilité d’une mousse. C’est cette sensibilité aux faibles perturbations dans les propriétés des interfaces qui complique considérablement leur étude. Les mousses de bière illustrent bien cette complexité engendrée par la diversité et la synergie des ingrédients « moussants ». Certaines présentent une mousse fine et humide, alors que d’autres ont une mousse «sèche» constituée de « grosses » bulles de gaz (quelques millimètres de diamètre).
4/Quels sont les mécanismes qui concourent à la stabilisation d’une mousse ?
Ils sont variés et liés à la dynamique des mousses. Le rôle des tensioactifs mais aussi d’autres substances est là encore déterminant. En diminuant la tension superficielle, le tensioactif favorise la formation de bulles dans le liquide. Mais il préside aussi à l’accumulation des bulles. A peine formées, les bulles montent généralement à la surface du liquide et s’entassent les unes sur les autres.
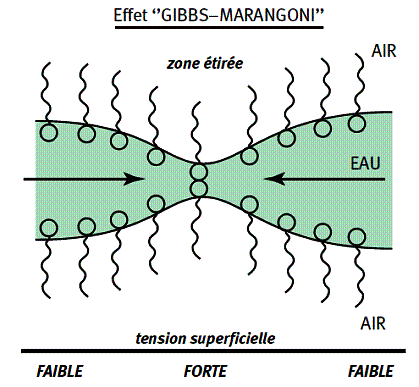
Au cours de ce processus, les films liquides qui se forment entre les bulles sont sujets à de forts étirements. Il est indispensable qu’ils résistent à la rupture sinon l’accumulation des bulles, autrement dit la mousse, ne se formera pas. Lors du rapprochement de deux bulles, le film liquide qui les sépare s’amincit en même temps que les interfaces liquide/gaz s’étirent. L’étirement des interfaces entraîne une diminution de la concentration de tensioactif aux interfaces. Il en résulte une augmentation de la tension superficielle dans la zone étirée et du même coup une différence de tension superficielle par rapport aux zones voisines.
Ce « gradient » de tension superficielle est à l’origine d’une force dirigée des zones de basse tension vers les zones de haute tension. Ce phénomène est bien connu de ceux qui font encore la vaisselle à la main : lorsque l’on verse une goutte de produit vaisselle (tensioactif) dans de l’eau où flottent des gouttes d’huile, une force dirigée de la zone de faible tension (là où se trouve le tensioactif) vers la zone de haute tension déplace les gouttes d’huile. Dans le cas de la mousse, la force due au gradient de tension superficielle entraîne le liquide des zones épaisses du film vers les zones plus minces. Cet effet, appelé effet de « Gibbs-Marangoni », s’oppose donc à l’étirement des films entre les bulles. Il a tendance à « stopper » l’étirement en conférant aux films étirés une certaine élasticité qui favorise la formation et la stabilisation de la mousse.
Lorsque ce mécanisme n’existe pas, il n’y a pas de mousse. C’est le cas des eaux gazeuses où les bulles de CO2 se cassent dès qu’elles arrivent à la surface de l’eau. Une fois formée, la mousse évolue et finit par disparaître. Plusieurs phénomènes sont en jeu. Il y a notamment le drainage et la diffusion gazeuse entre les bulles, des phénomènes qu’il est nécessaire d’entraver si l’on souhaite stabiliser la mousse. L’évolution des mousses de bière est une belle illustration de ces deux phénomènes. Certaines mousses dites « sèches » sont initialement humides mais évoluent rapidement sous l’effet du drainage qui provoque leur assèchement et le tassement des bulles. Le drainage est le résultat de la gravité qui a tendance à tirer vers le bas le liquide contenu dans les films. Le drainage est plus rapide lorsque les bulles de gaz sont grosses car elles sont plus facilement déformables. Elles perdent leur sphéricité et deviennent polyédriques. En revanche, les petites bulles de gaz des mousses de bière « humides » restent plus longtemps sphériques, et cela leur permet de retenir plus longtemps le liquide de la mousse.
La diffusion gazeuse entre les bulles concoure à précipiter les mousses vers leur destin fatal. Elle intervient principalement lorsque le drainage s’affaiblit. La diffusion est liée aux différences de pression entre les bulles. La pression dans les petites bulles est plus élevée que dans les grosses (loi de Laplace). De ce fait, les petites disparaissent en perdant leur gaz au profit des grandes : le nombre de bulles diminue et leur taille moyenne augmente. L’effet du drainage s’accentue alors : les films deviennent de plus en plus minces et les bulles finissent par éclater. On peut donc améliorer la stabilisation d’une mousse en limitant le drainage ou en bloquant le passage du gaz d’une bulle à l’autre. Pour diminuer le drainage, on augmente la viscosité du liquide et la viscosité de l’interface en ajoutant des protéines au liquide par exemple. C’est le cas de bon nombre de mousses alimentaires qui contiennent des protéines telles que l’albumine ou la gélatine ou bien encore le carboxy-méthyl-cellulose qui est une substance synthétique. Quant à la perméabilité au gaz, elle peut être diminuée en ajoutant des ingrédients qui permettent aux tensioactifs de s’organiser en bicouche plutôt qu’en monocouche.
5/Et parfois, on ne recherche pas à stabiliser une mousse...
Si l’on fabrique des peintures à l’eau ou de la pâte à papier par exemple, le moussage est un handicap. De même pour les lessives. Une lessive doit mousser pour satisfaire le consommateur, mais si la mousse devient trop abondante dans la machine à laver, il y a un risque de débordement.
Et puis la mousse ne doit pas persister longtemps sinon elle finit avec l’eau de lavage dans les cours d’eau, polluant et dénaturant le paysage. C’est la raison pour laquelle certains alkylsulfonates de sodium furent interdits dans les lessives à partir de 1965. Ils étaient responsables d’amas de mousses stables à la surface des rivières. Pour contrôler la formation des mousses ou leur destruction (démoussage), on a recours à des agents antimousse qui agissent sur la formation et la durée de vie de la mousse. Depuis une cinquantaine d’années, on utilise l’alcool cétylique dans les bains de textiles, mais la compréhension des mécanismes en jeu n’est que partielle. Les anti-mousses sont constitués de particules hydrophobes dispersées dans une huile ou dans des polymères siliconés. C’est le cas des silicones. Leur rôle consiste à faire des « trous » (s’intercaler) dans les films liquides de la mousse. Pour cela, ils sont aidés par le phénomène de drainage qui amincit les films jusqu’à ce que l’épaisseur du film devienne aussi petite que celle des particules hydrophobes. Il se produit alors le phénomène de démouillage. Tout ingrédient favorisant le démouillage déstabilise une mousse liquide.
« Reproduction d'un extrait de l'article « Les secrets des mousses, une interview de Claude Treiner » de Marielle Vergès publié dans la revue Découverte de novembre 2005, numéro 332, p. 24-31, avec l'aimable autorisation d'Universcience. »
c. Les mousses solides
Une mousse solide provient d’une mousse liquide, par solidification de ce liquide. Celle-ci peut être obtenue de différentes manières :
– solidification (par exemple au cours d’une trempe thermique),
– polymérisation,
– gélification.
Lorsque les films liquides séparant les bulles de la mousse liquide survivent à la solidification, on parle de mousse fermée, car chaque bulle est encore fermée. Dans le cas contraire, on parle de mousse ouverte.
Le pain est un exemple de mousse solide : la pâte s’est solidifiée lors de la cuisson. La mie de la plupart des pains est une mousse ouverte, et sèche assez vite car l’air circule en son sein.
La mie de certains pains est cependant une mousse fermée : ces pains sèchent beaucoup moins vite, même une fois entamés.
Des mousses synthétiques sont très répandues, comme les éponges utilisées pour le nettoyage. Ces mousses de synthèse sont, en général, des polymères, tels :
– le polypropylène expansé,
– la mousse de polyuréthane,
– la mousse isolante d’urée-formaldéhyde,
– le polystyrène : expansé, ou extrudé.
IV/Les membranes
1/Définition
Du latin « membrana » : peau qui recouvre les os.
Par extension, une membrane en matériau est une paroi permettant d’isoler deux milieux mais pouvant aussi laisser passer certaines substances ou informations.
2/Traitement de l’eau par technique membranaire
Tout le monde connaît les techniques de séparation de mélanges hétérogènes à base de filtration permettant par exemple d’obtenir des eaux limpides à partir d’eau boueuses. De nouvelles techniques, très performantes ont vu récemment le jour. Ces techniques dites de séparation par membranes constituent une mini-révolution dans le domaine du traitement de l’eau. Leur principe consiste non plus à éliminer chimiquement les micropolluants mais à les extraire physiquement. Elles présentent en effet le très gros avantage de n’utiliser aucun réactif chimique, sauf pour leur entretien. Très fiables, elles permettent de traiter des eaux très polluées et de produire une eau très pure, sans goût désagréable ni mauvaises odeurs, et de qualité constante, quelles que soient les variations de qualité de l’eau à traiter. Elles commencent depuis peu à être utilisées à grande échelle au niveau industriel. Le seul inconvénient de ces nouveaux traitements est leur coût élevé.
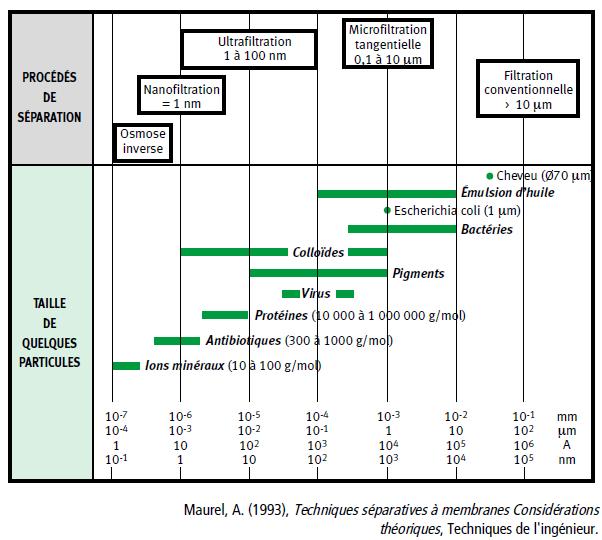
L’ultrafiltration s’effectue en retenant certaines particules mais en faisant traverser l’eau à travers une membrane dite semi-perméable sous une pression de 0,2 à 2 bars au dessus de la pression atmosphérique. Deux paramètres caractérisent une membrane d’ultrafiltration :
– la perméabilité : c’est le débit d’ultrafiltrat qui est fourni par 1 m2 de membrane. L’unité est le l/m2/h,
– le seuil de coupure (cut-off) qui indique la taille à partir de laquelle les molécules seront entièrement retenues. Le seuil de coupure est une masse moléculaire (ex: seuil = 15 000) signifie que toutes les molécules dont la masse moléculaire est supérieure à 15 000 g.mol-1 seront retenues à 100%).
Le principe de la nanofiltration est très semblable à celui de l’ultrafiltration mais nécessite une pression de travail de 10 à 20 bars et une membrane offrant une porosité (diamètre moyen des pores) dix fois plus faible.
A l’extrême, pour désaliniser l’eau de mer à l’aide d’une membrane d’osmose inverse, il faut forcer l’eau de la solution saumâtre (concentration en sels élevée) à aller dans la solution douce (concentration en sels basse). Ainsi, la saumure devient plus concentrée. Pour provoquer cette diffusion contraire à la loi physique de l’osmose (d’où le nom d’osmose inverse), il faut appliquer une pression d’opération d’environ 60 bars pour obtenir de l’eau pure à partir d’eau de mer.
3/Matériaux des membranes utilisés dans les techniques de filtration
Au 18e siècle, l’abbé Jean Antoine Nollet avait observé qu’une membrane constituée d’une vessie de porc laissait passer un flux d’eau douce pour diluer une solution saline séparée de celle-ci par la membrane; ce fut probablement la première observation du phénomène d’osmose.
Depuis, la technique a bien évolué et la venue des matières synthétiques sur le marché a permis de réaliser des membranes semi-perméables de manière industrielle. Leur structure asymétrique est constituée d’un support macroporeux (pour la tenue mécanique) et d’une peau ou couche superficielle de plus faible porosité. Le but est d’assurer une bonne sélectivité des particules retenues avec une faible résistance au transfert du solvant tout en ayant une bonne tenue mécanique. Les matériaux synthétiques à la base des membranes sont souvent des polymères organiques (acétate de cellulose, polysulfone ... ). Les membranes inorganiques sont plus résistantes à l’action des solvants organiques, aux pH extrêmes en milieu aqueux ainsi qu’aux hautes températures mais elles sont également plus couteuses :
***Membranes organiques fabriquées à partir de polymères organiques tels que l’acétate de cellulose, de polyamides, ...
***Membranes minérales constituées de matériaux tels que les matières céramiques, le métal fritté et le verre. Ces matériaux résistent bien aux hautes températures et aux agressions chimiques. Parmi elles, la zircone de formule ZrO2 est par exemple très résistante aux attaques de réactifs acides, a une porosité moyenne d’une quarantaine de nm et possède une charge négative de surface au-dessus de pH8.
***Membranes composites caractérisées par la structure asymétrique d’une peau très fine et constituées de plusieurs couches différenciées par leur nature physico-chimique (organique, organo-minérale ou minérale).
Le choix d’une membrane se fait tout d’abord par rapport à la séparation à réaliser : de façon générale la taille des pores est généralement 2 fois plus petite que l’espèce la plus petite à retenir (pour assurer une bonne rétention tout en limitant le colmatage en profondeur de la membrane). Le matériau doit être choisi afin de limiter les affinités avec les espèces du fluide à traiter (pour limiter les phénomènes d’adsorption). Il faut enfin satisfaire les contraintes du fluide (pH, température) et du domaine d’utilisation (stérilisation, agrément ... ) et que le coût soit compatible avec la valeur ajoutée du produit.
4/Situation des techniques de séparation par membranes en fonction de la taille retenues (Maurel 1993).
Résumé :
Une émulsion est une dispersion de gouttelettes d’un liquide dans un autre liquide, non miscible avec le premier. Par exemple, la mayonnaise est une émulsion de gouttelettes d’huile dans l’eau.
Les tensioactifs, que l’on appelle aussi agents de surface (le terme anglais étant « surfactants »), sont des substances solubles dans l’eau et ayant la propriété de se concentrer, de s’agréger, aux interfaces entre l’eau et d’autres substances
peu solubles dans l’eau, les corps gras notamment. On les rencontre dans de nombreux domaines, comme les huiles moteur, les produits pharmaceutiques, les savons ou les détergents.
Ces molécules présentent au moins deux parties d’affinité différente :
– l’une est hydrophile (affinité pour l’eau),
– l’autre est lipophile (affinité pour les graisses).
De telles substances sont dites amphiphiles ( du grec amphi , « des deux cotes », et « philos », ami).
La partie lipophile est généralement constituée d’une chaîne carbonée assez longue, et qui doit être linéaire (donc non ramifiée) pour être biodégradable.
La partie hydrophile est une extrêmité généralement ionique.
Une mousse est un milieu complexe constitue :
– d’un gaz disperse dans un liquide : on parle de « mousse liquide ». C’est le cas de la mousse a raser, la mousse du shampooing ou la mousse de la bière.
– d’un gaz disperse dans un solide : on parle de « mousse solide ». C’est le cas des mousses de polyuréthane, utilisées pour fabriquer des sièges, ou encore les mousses métalliques utilisées dans l’industrie automobile afin de diminuer le
poids des véhicules.
Une membrane est une « peau » qui peut être perméable, semi-perméable, ou étanche. Les applications sont diverses et variées.