Spe SPC - FABRICATION D'UN SAVON
Obiet du TP:
Fabrication d'un savon; étude de quelques propriétés des solutions aqueuses de savon.
Matériel et produits:
matériel de chauffage à reflux; bécher de 250 mL; éprouvette graduée; filtre Büchner; tubes à essais , pipette graduée de 5 mL; gants à utiliser lors de la manipulation de la solution de soude concentrée; spatule ; entonnoir et papier filtre; petit moule destiné à recueillir et égoutter le savon .
Huile de table; éthanol; solution de soude alcoolisée (88 de soude + 100 mL d'eau + 450 mL d'éthanol) ; eau salée saturée ; solution à 0,1 mol.L-1 de chlorure de calcium ; copeaux de savon ; pierre ponce.
I/ FABRICATION D'UN SAVON
a)Principe:
Une solution concentrée de soude est utilisée pour réaliser la saponification d'un corps gras . Afin de favoriser le contact entre les réactifs, ceux-ci sont mis en solution dans l'éthanol. Le savon qui se forme lentement, à température élevée ( ici, à environ 100°C),est peu soluble dans l'eau salée; il est relargué dans une solution concentrée de chlorure de sodium.
b)Protocole:
* Dans un ballon de 250 mL, introduire à l'aide d'une éprouvette graduée:
- 15 mL de solution de soude alcoolisée (attention, mettre des gants)
- 17 mL d'huile de table
- quelques grains de pierre ponce.
* Adapter le réfrigérant et chauffer à reflux le mélange réactionnel.
* Maintenir une ébullition douce pendant 30 minutes.
* Verser le mélange réactionnel encore chaud dans un bécher de 250 mL contenant environ l00 ml solution saturée de chlorure de sodium. Agiter: le savon précipite.
* Filtrer le mélange obtenu sur un filtre (environ le contenu d'un tube à essais). Si la filtration est trop lente on peut envisager une filtration büchner .
* Changer le filtre, y déposer le savon et le rincer modérément à l'eau distillée.
* Mettre le savon à sécher dans un petit moule percé de trous pour l'égouttage
Il est déconseillé d'utiliser le savon ainsi obtenu pour se laver les mains ! en effet, il contient encore beaucoup de soude; il est donc caustique.
Q1) Écrire l'équation de la réaction de saponification en admettant que l'huile n'est formée qu triglycéride de l'acide oléique Cl7H33-COOH.
Q2) Quel est le rôle de l'éthanol introduit dans le mélange réactionnel lors de la réaction de saponification ?
Q3) Quel est le rôle de l'eau salée utilisée en fin de réaction ?
Q4)L'huile a une densité de 0,9; I'un des réactifs est-il en excès (faire la même hypothèse simplificatrice que dans Q1)
Q5) Quelles sont les espèces chimiques présentes dans le filtrat ?
II/- QUEQUES PROPRIÉTÉS DES SOLUTIONS AQUEUSES DE SAVON
a)Préparation de la solution de savon:
* Dans 100 mL d'eau distillée , introduire 2 ou 3 g de copeaux de savon et agiter.
* Filtrer afin d'obtenir une solution limpide . Soit S cette solution .
* Déterminer approximativement son pH (à l'aide de papier indicateur).
Q6) Quel est le pH de la solution aqueuse de savon ?
b) Action de l'eau salée:
* À 2 mL de solution S, ajouter goutte à goutte un solution concentrée de chlorure de sodium. Noter les observations.
c)Action moussante des savons:
L'expérience montre que, en général, un savon qui mousse bien a de bonnes propriétés détergentes. Il s'agit de tester l'action d'eaux plus ou moins dures, c'est-à-dire d'eaux contenant plus ou moins de calcium ou magnésium, sur les propriétés moussantes d'un savon.
*Numéroter trois tubes à essais et introduire:
dans le tube n° 1: 5 mL d'eau déminéralisée
dans le tube n°2: 5 mL de solution de chlorure de calcium (jouant le rôle d'eau très dure)
dans le tube n°3: 5 mL d'eau du robinet
*Ajouter alors dans chaque tube 10 gouttes de solution S et observer.
* Agiter énergiquement les trois tubes
Q7) comparer les quantités de mousse obtenues.
d)mode d'action des savons :
L'ion carboxylate et l'eau :
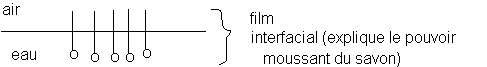
où ![]() représente un ion
caboxylate RCOO- :
représente un ion
caboxylate RCOO- :
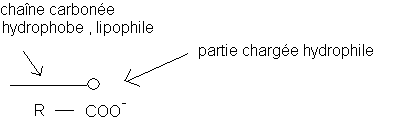
La chaîne carbonée n'a aucune affinité avec l'eau (hydrophobe) . Elle a par contre beaucoup d'affinité avec les corps gras (lipophile)
Le groupe carboxylate COO- a avec l'eau des liaisons hydrogène (liaison intermoléculaire entre un atome d'hydrogène d'une molécule et un atome d'oxygène d'une autre molécule) ce qui lui donne un caractère hydrophile marqué .
On désigne par le terme <<tensio-actif>> des composés dont une partie de la molécule (ou de l'ion) est hydrophile et l'autre hydrophobe .
Si la concentration du savon est grande, il se forme dans la solution des micelles : agglomérat de 10 à 100 ions carboxylate.
e)Propriétés détergentes :
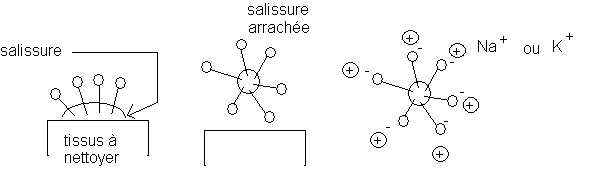
La salissure est "arrachée " au tissu et dispersée dans le liquide à cause des charges positives (Na+ ou K+ )
III/Mecanisme réactionnel :
La réaction de saponification est une réaction d'hydrolyse en milieu basique . Le mécanisme de cette réaction peut être décrit en trois étapes :
a)Première étape : addition de HO- sur l'ester :
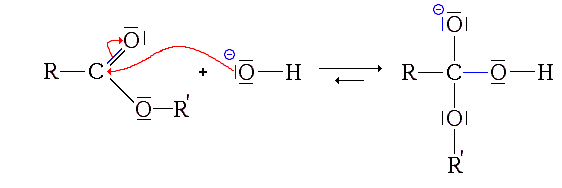
les liaisons C-O sont polarisées , l'oxygène étant plus électronégatif que le carbone . Le carbone du groupe carboxyle est de ce fait un site électrophile.
Par ailleurs l'oxygène de l'ion hydroxyde est un site nucléophile . Cette compatibilité entre les deux sites va être à l'origine de l'addition de l'ion hydroxyde sur l'ester . L'approche de l'ion hydroxyde du carbone de l'ester du groupe carboxyle va favoriser le départ de l'un des doublets de la liaison C=O vers l'oxygène qui est engagé dans cette liaison.
L'ion obtenu est représenté ci-dessus.
b)Deuxième étape:élimination du groupe alcoolate :
L'ion obtenu précédemment est instable : un réarrangement électronique conduit à l'élimination d'un ion alcoolate et la formation de l'acide .
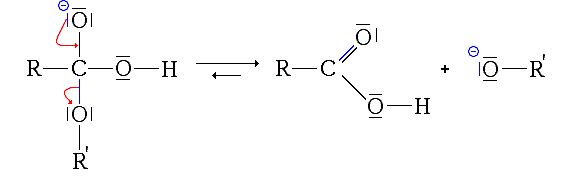
L'acide carboxylique formé a un pKa compris en général entre 3 et 4 se trouve dès lors en présence de la base relativement forte qu'est l'ion alcoolate, dont le pKa est compris entre 18 et 20, ce qui va donner lieu à une réaction acido-basique.
c)Troisième étape : Réaction acide-base
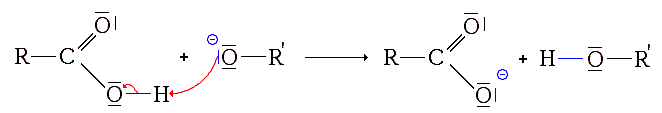
De par la polarisation de la liaison O-H , H est un site électrophile . Celui-ci réagit avec le site nucléophile de l'ion alcoolate .
IV/Exercice :
Exercice à chercher : 13 page 156
TP Savon (spe) : Correction :
1)L'huile peut être considérée comme le triester du glycérol obtenu à partir de l'acide oléique. Ecrivons la réaction correspondante :
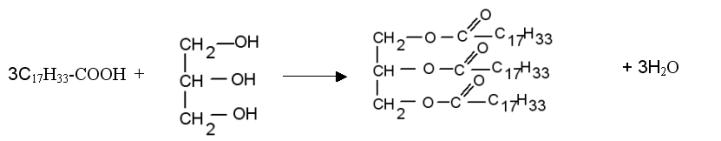
la réaction de saponification (hydrolyse en milieu basique) est :
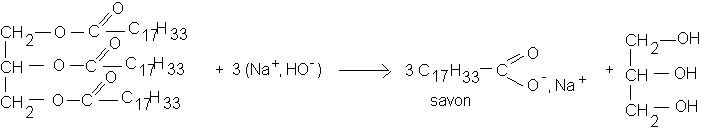
2)L'éthanol favorise le contact entre les réactifs
3)L'eau salée utilisée en fin de réaction favorise la précipitation du savon (relargage)
4)* soude :n = m/M=(88/40)/550*15= 0,06 mol CbVb = 10*20 10-3 = 0,2 mol
* huile : n=m/m = rV/M= reau*d*V/M = 1000 g.L-1 *0,9*17. 10-3 /884=0,017 mol (Mhuile = 884 g.mol-1)
La soude est en excès car n(huile introduit)<n(soude introduit)/3 :[ 0,017 < 0,06/3=0,02 ]
5)Dans le filtrat on trouve :
- de la soude (excès)
-du glycérol
-de l'alcool
6) pH > 7 : la solution de savon est basique .
7)C'est dans le tube n°1 (eau déminéralisée ) que la mousse est la plus abondante : cela signifie que c'est en eau douce que le savon est le plus efficace .
En solution saline (Na+ + Cl-) ou en eau dure (riche en Ca2+ et Mg2+) , le savon précipite : cette situation est défavorable à l'action détergente du savon .