TP spécialité SPC : Eau et énergie
I/L'importance de l'hydrogène :
a)Un vecteur d'énergie
L’hydrogène ou plus exactement le dihydrogène (H2) est un vecteur énergétique (plutôt qu’un carburant) car il n'existe pratiquement pas à l'état pur. En effet, dans la nature, on le retrouve essentiellement combiné à l’oxygène (dans l'eau) ou à de longues chaînes carbonées (dans les hydrocarbures). Bref, il faut donc d’abord dépenser de l’énergie pour produire du dihydrogène à partir d’eau ou d’hydrocarbures avant de récupérer de l’énergie via sa combustion dans une pile à combustible, par exemple. Le grand intérêt de ce vecteur énergétique est qu’il peut se stocker, contrairement à un autre vecteur énergétique très populaire : l’électricité.
b)Des avantages du dihydrogène:
-C'est le plus énergétique des vecteurs en terme de masse : à masse identique que le gaz naturel , il produit 2,2 fois plus d'énergie que ce dernier .
-ni toxique, ni polluant
-ses modes de fabrication et d'utilisation sont variés et son transport aisé .
c)Des inconvénients du dihydrogène :
-Bien que l'atome d'hydrogène est l'atome le plus abondant sur terre et dans l'univers , le dihydrogène H2 n'existe pas à l'état naturel sous forme moléculaire : il faut donc le fabriquer .
-Beaucoup plus léger que le gaz naturel , cela a pour conséquence de compliquer son transport et son stockage.
-il est sans odeur et sans couleur , ce qui ne facilite pas sa détection.
-il est très inflammable dans l'air.
-il a une mauvaise image dans le public .
d)une réponse aux problèmes énergétiques de notre temps et de l'avenir ?
Ce vecteur d'énergie vaut sans doute la peine que l'on aborde calmement ses caractéristiques . Il est certainement une réponse aux interrogations de notre temps sur les problèmes énergétiques auxquels nous sommes confrontés . L'avenir énergétique de notre planète passe certainement par sa domestication.
Nous venons d'évoquer la molécule , donc l'aspect chimique . Ce serait être incomplet que de ne pas mentionner les recherches sur le noyau de cet atome dans la perspective de réaliser la fusion (Cadarache) , la meilleure des réponses qui soit aux problèmes énergétiques de l'humanité (pas de déchets , pas de gaz à effet de Serre ……)
II/Fabrication du dihydrogène au laboratoire par électrolyse de l'eau :
a)Manipulation :
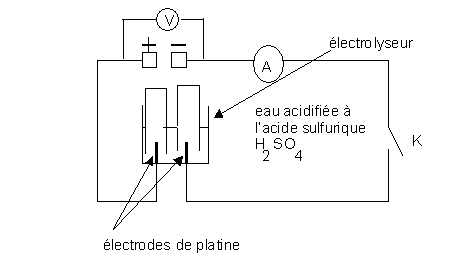
Q1)Reproduisez le schéma sur votre copie en indiquant :
-l'anode et la cathode de l'électrolyseur
-le sens du courant dans le circuit et dans les électrodes de l'électrolyseur
-le sens de déplacement des électrons au niveau des électrodes
-On déclenchera le chronomètre lorsqu'on fermera l'interrupteur K et on ne l'arrêtera qu'à la fin de la manipulation. -On fera en sorte que l'intensité du courant soit pratiquement constante pendant toute la durée de la manipulation .
-lorsque l'un des tubes à essai sera rempli de gaz , on ouvrira l'interrupteur et on notera :
*la durée de l'expérience Dt = ………..
*l'intensité du courant I=………
*la tension indiquée par le voltmètre U= ………..
Q2)Les gaz dégagés aux électrodes sont le dihydrogène H2 à la cathode et le dioxygène O2 à l'anode . Proposez une méthode qui permette de mettre en évidence chacun de ces deux gaz .
Q3)Comparer les volumes des deux gaz obtenus à la fin de l'électrolyse .
b)Interprétation :
Les deux couples qui interviennent dans cette expérience sont (O2/H2O) et (H+/H2) . Les demi-équations électroniques s'écrivent :
2H+ + 2e ---> H2 | x 2
2H2O ---> O2 + 4H+ + 4e
-----------------------------------
4H+ + 2H2O --->2H2 + 02 +4H+ , soit en simplifiant : 2H2O ---> 2H2 + O2
Il s'agit bien de la décomposition de l'eau . La réaction fournit deux fois plus de H2 que de O2 , et comme le volume molaire (même température , même pression) des deux gaz est le même , nous avons VH2 = 2*VO2 , ce qui correspond bien à ce qui a été observé expérimentalement.
c)Aspect quantitatif : quantité d'électricité et quantité de matière
Q3)Calculer la quantité d'électricité Q qui a circulé dans le circuit durant l'expérience , sachant que Q=I*Dt .
Q4)Quel est le volume de dihydrogène dégagé au cours de l'expérience? (on pourra mesurer le volume du tube à essai en utilisant une éprouvette graduée).
Q5)Sachant que le volume molaire des gaz dans les conditions de l'expérience est égal à 24 L.mol-1 , quelles sont les quantités de matière nH2 de H2 et nO2 de O2 obtenues au cours de l'expérience ?
Q6)On peut montrer que nH2 = Q/(2*96500) . Cette relation est-elle vérifiée ?
d)Bilan énergétique :
Q7)Calculer l'énergie électrique W1 = U*I*Dt fournie par le générateur pendant l'expérience
Q8)Quelle est est la masse de dihydrogène obtenue au cours de l'expérience ?
Q9)En déduirel'énergie chimique stockée W2 sachant que le pouvoir calorique massique du dihydrogène est Cm =141,8 MJkg-1
Q10)Estimer le rendement énergétique r=W2/W1
Q11)Calculer l'énergie que devraient développer les éoliennes de la centrale de Prenzlau pour remplir en 24 h ses trois réservoirs de 1350 kg de dihydrogène si les électrolyseurs de la centrale de Prenzlau avaient le même rendement .
III/Production du dihidrogène à partir d'hydrocarbures :
*Réformage de sources d'énergies fossiles : les molécules d'hydrocarbures sont cassées à haute température . Exemple : méthane + eau+catalyseur nickel .
Produit du CO : CH4 + H2O ---> 3H2+CO
*Oxydation partielle d'hydrocarbures : dans tous les cas , ces transformations produisent du dioxyde de carbone CO2 (augmentation de l'effet de serre , réchauffement climatique…)
IV/Production de dihydrogène du futur
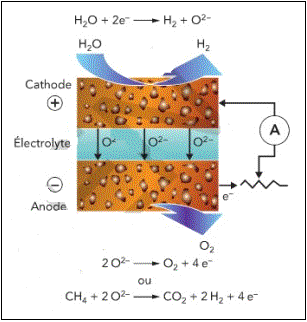
1/Électrolyse à haute température, EHT
« L'électrolyse à haute température consiste à dissocier la molécule d'eau en dihydrogène et dioxygène à des températures comprises entre 700 °C et 1 000 °C. [...] Par rapport aux procédés classiques d'électrolyse de l'eau, la haute température présente des avantages à trois niveaux. Au niveau énergétique d'abord : l'énergie totale à fournir est moins importante grâce à l'augmentation de la cinétique des réactions (3,1 kWh/Nm3 produits, pour l'ENT, contre 4,1 kWh/Nm3 produits, pour l'électrolyse classique). [...] LENT permet de travailler à forte densité de courant, d'où une forte capacité de production dans un volume réduit.
Au niveau économique enfin : l'apport d'une partie significative de l'énergie sous forme de chaleur au lieu d'électricité permet de diminuer le coût d'exploitation. »
Extrait de D. GALLET et R. GRASTIEN, L'électrolyse haute température »,Clefs OEA, n° 50/51, hiver 2004-2005.
2/Décomposition de l'eau par cycle thermochimique
« Les cycles thermochimiques permettent de réaliser la décomposition de l'eau à une température inférieure à celle de la décomposition directe. Des substances chimiques sont introduites pour, au travers d'une série de réactions de combinaisons avec l'eau et entre elles, puis de dissociations, amener à la production de dihydrogène et de dioxygène, tout en restituant les substances chimiques initiales. LI Le premier cycle étudié est le cycle iode soufre. [...1 »
Extrait de F. WERKCFF, a Mémento de l'Hydrogène », fiche 3.2.2, site AFHZ révision mars 2007.
Le cycle iode-soufre est basé sur la décomposition de deux acides à haute température, l'acide sulfurique, H2SO4, et l'acide iodhydrique, HI.
(1)H2SO4 --> H2O + S03 (400-600 °C) et SO3 ---> SO2 +1/2O2 (800-900 °C)
(2) 2HI---> H2 + I2 (200-400 °C)
(3) SO2 + 2 H2O + I2 ---> H2SO4 (aq) + 2 Hl (aq) (25-120 °C)
D'après J.-M. BORGARD et col.<< La décomposition de l'eau par cycle thermochimique », Clefs CM, n° 50/51, 2004-2005

3/Bioproduction du dihydrogène
« Les organismes photosynthétiques, comme certaines algues vertes unicellulaires ou des cyanobactéries, possèdent l'avantage de produire du dihydrogène à partir de l'énergie solaire en utilisant l'eau comme donneur d'électrons et de protons sans dégagement de gaz à effet de serre (CO2) inhérent aux autres organismes hétérotrophes.
Dans ce cas, un procédé totalement propre basé sur la photosynthèse peut être envisagé, avec comme source d'énergie les deux plus importantes ressources de notre planète, l'eau et le Soleil. »
Extrait J. LEGRAND, « Mémento de l'Hydrogène » fiche 3.3.2, site AFH2, révision oct. 2003.
4/Transformation thermochimique de la biomasse
La biomasse, obtenue par photosynthèse de CO2 et H2O, capte l'énergie solaire pour produire un ensemble de molécules (cellulose, lignocellulose, lignine) de composition équivalente à C6H904.
La gazéification de la biomasse à la vapeur d'eau donne un gaz dit de synthèse, (CO + H2), dont on peut tirer des carburants liquides (méthanol ou hydrocarbures) ou gazeux (CH4 ou H2). Dans le cas où on veut privilégier la production de dihydrogène, une réaction dite de « gaz shift » permet la conversion du gaz de synthèse en CO2 et H2.
D'après G. CLAUDET, 0 Mémento de l'Hydrogène », fiche 3.3.1, site AFH2, révision 2003.
5/Une feuille pleine d'énergie
La photo-électrolyse produit du dihydrogène par illumination d'un semi-conducteur.
« C'est une feuille artificielle. Tout comme une feuille d'arbre, elle transforme la lumière du Soleil en énergie. Mais, contrairement à cette dernière, elle ne stocke pas de l'amidon, elle génère de l'électricité.
Conçue par une équipe de chercheurs du Massachusetts Instituts of Technology (MIT), qui publie ses travaux dans Science, cette cellule solaire en silice renferme différents catalyseurs. Il suffit de l'exposer au Soleil dans un récipient d'eau ordinaire. Pouvant casser la molécule d'eau, elle produit, sur une face, des bulles de dioxygène et, sur l'autre, des bulles de dihydrogène.
Les deux gaz récupérés séparément alimentent une pile à combustible pour obtenir de l'électricité. Ce système apte à séparer l'hydrogène et l'oxygène de l'eau est le premier à n'utiliser que des matériaux courants et peu coûteux dans une solution non corrosive. »
Extrait de G. Dos SANTOS, Une feuille pleine d'énergie ». Le Point oct. 2011.

V/Piles d'oxydoréduction :
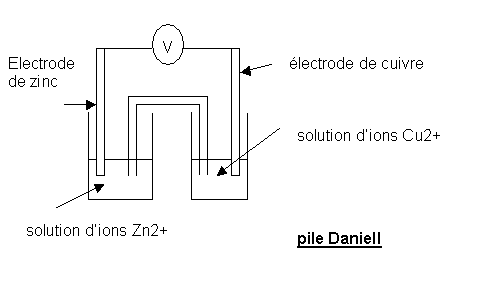
1/Rappel : la pile Zn/Cu
2/La pile à combustible : description
En recombinant du dihydrogène et du dioxygène , il est possible de créer simultanément de l'eau , de la chaleur et de l'électricité .

Animation : http://d.ruze.free.fr/pile.html
La réaction s'opère au sein d'une structure essentiellement composée de deux électrodes séparées par un électrolyte souvent solide , conducteur protonique
3/Avantages et inconvénients de la pile à combustible :
a)Avantages
-pile qui fonctionne tant qu'il y a du dioxygène O2 et du dihydrogène (n'emmagasine pas des produits comme dans les autres piles).
-peu de polluants
-bon rendement énergétique.
b)Inconvénients :
-mise en œuvre complexe
-très coûteuse
-utilise du dihydrogène , qui présente quelques dangers et qui doit être fabriqué .
VI/Exercices :
-pages 53 et suivantes :3,4,11
-Etude documentaire page 59
Correction TP spécialité SPC : Eau et énergie (hydrogène)
1)
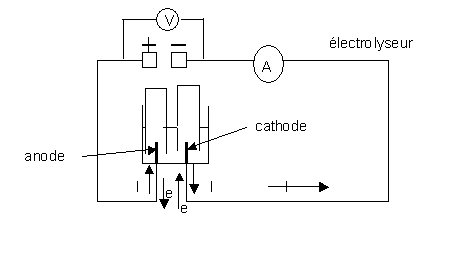
A l'extérieur du générateur , le sens conventionnel du courant est du pôle positif du générateur au pôle négatif. Dans les conducteurs métalliques , les électrons circulent en sens inverse du courant .
Remarque : Dans une solution , le courant est du à un déplacement d'ions (et non d'électrons)
*la durée de l'expérience Dt = 1mn 15
*l'intensité du courant I=2 A
*la tension indiquée par le voltmètre U= 10 V
2)Lorsqu'on présente une flamme à l'ouverture d'un tube à essais qui contient du dihydrogène , on entend une petite détonation . Lorsqu'on introduit une bûchette légèrement portée au rouge dans un tube à essais contenant du dioxygène , la bûchette s'enflamme .
3)le volume de dioxygène dégagé à l'anode est égal à la moitié de celui de dihydrogène obtenu à la cathode .
3 bis ) Q= I*Dt = 2*(15+60) = 150 C
4)VH2 = 21 mL
5)nH2 = VH2 /Vm= 21.10-3 /24 (L/(L.mol-1) = 8,75.10-4 mol .
nO2 =nH2/2 = 4,37.10-4 mol
6)La relation proposée donne nH2= 150/(2*96500)=7,7.10-4 mol . Les deux valeurs trouvées sont du même ordre de grandeur .
7) W1 = 10*2*75= 1500 J
8)mH2 = nH2* MH2 = 8,75.10-4 *2 =1,75.10-3 g
9)W2 = Cm* mH2 = 141,8.106 * 1,75.10-6 = 250 J
10)Le rendement énergétique est donc r=250/1500= 16,6 %
11)Avec un rendement de 100 % l'énergie électrique à fournir serait de W'2 = Cm*1350*3= 141,8.106*1350*3 =5,7.1011 J . Avec un rendement r , les générateurs doivent fournir une énergie égale à W'1 = r*W'2= 0,166*5,7.1011=9,5.1010 J .