Tp3 -spe ch - Traitement de l'eau : dureté et désinfection
I/Production d'eau de Javel :
a)désinfection de l'eau :
Par définition , une eau est potable quand deux litres peuvent en être consommés par jour , à vie, sans conséquence pour la santé. L'OMS recommande que 3 mg d'ions hyppochlorite ClO- (présents dans l'eau de Javel) soient ajoutés par litre d'eau pour une désinfection satisfaisante.
Nous allons voir comment il est possible de produire ce désinfectant .
b)Electrolyse d'une solution de chlorure de sodium :
On réalise l'expérience ci-dessous :

Q1)Reproduisez le schéma sur votre copie en indiquant :
-l'anode et la cathode
-le sens du courant dans les électrodes
-le sens des électrons dans les électrodes .
Q2)Ajoutez quelques gouttes de phénolphtaléine du coté de la cathode et quelques gouttes d'indigo à coté de l'anode . Quelles sont vos observations ?
La coloration en rose de la phénolphtaléine provient de la formation d'ions HO- à proximité de la cathode , la décoloration de l'indigo à proximité de l'anode est due au dégagement de dichlore Cl2 .
- à la cathode : 2H2O + 2e = H2 + 2HO-
- à l'anode : 2Cl- = Cl2 + 2e
Si on mélange la solution après électrolyse , Cl2 et HO- réagissent pour donner de l'eau de Javel (ions hypochlorites) :
Cl2+ 2HO- = ClO- + Cl- + H2O
Verser de la solution dans un tube à essais et ajouter quelques gouttes d'acide chlorhydrique .
Q3) Qu'observez vous , caractérisez le dégagement gazeux .
Le dégagement gazeux obtenu est le résultat de la réaction obtenue entre les ions hypochlorite ClO- et l'acide chlorhydrique (H+, Cl-)
II/Dureté de l'eau :
a)Définition :
La dureté d'une eau traduit sa teneur en ions calcium et magnésium .Une eau trop dure entraîne un entartrage des canalisations et de l'électroménager. Pour traiter cette eau , il est possible d'utiliser une carafe filtrante.
Une dureté raisonnable se situe entre 15 et 25 °f (degré français) . Un degré français est tel que la somme des concentrations en ions calcium et magnésium est [Ca2+] + [Mg2+] = 1,0.10-4 mol/L.
b)Détermination de la dureté d'une eau :
Nous allons réaliser un titrage complexométrique .
1-Principe
En milieu basique, les ions éthylènediaminetétraacétate ( EDTA) , notés Y4-, réagissent avec les ions
calcium ou magnésium pour former des ions complexes, stables et incolores selon les réactions :
Ca2+(aq) + Y4-(aq) à[CaY]2-(aq)
Mg2+(aq) + Y4-(aq) à[MgY]2-(aq)
L'indicateur de fin de réaction est le noir d'eriochrome T ( NET ), noté In3-, qui est bleu, libre, en milieu basique mais prend la couleur rose en présence des ions calcium et magnésium, à cause de la formation d'ions complexes [CaIn]-(aq) et [MgIn]-(aq).
Afin de maintenir le pH constant, voisin de 10, au cours du dosage, on ajoute une solution tampon ammoniacal (dont le pH varie peu) .
2-Manipulation
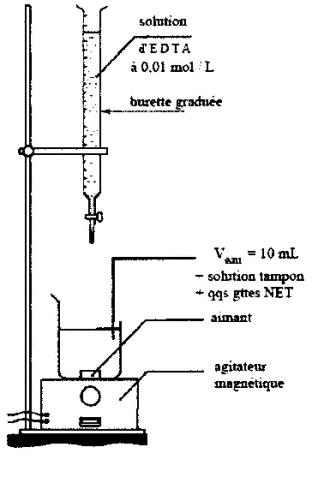
On remplit la burette graduée, après l'avoir rincée avec la même solution, d'une solution d'EDTA de concentration c = 10-2 mol/L. Dans un erlenmeyer, on place un volume V=10 mL d'eau de Contrexéville, quelques gouttes de NET et 10 mL de solution tampon ammoniacal.
On verse ensuite au goutte à goutte l'EDTA jusqu'à l'équivalence dont on repère le volume Veq.
Q4)Lors de la réaction de titrage avec l'EDTA, quelle est la couleur du milieu réactionnel en présence de NET avant l'équivalence, et quelle est la couleur après l'équivalence ?
Q5)Faire le schéma annoté du dispositif de dosage .
Q6)Définir l'équivalence
Q7)Noter le volume d'équivalence Veq
3- Interprétation - Résultats
Pour simplifier l'écriture, on notera M2+ la somme des ions Ca2+ et Mg2+ présents dans l'échantillon titré.
Q8)Ecrire l'équation de la réaction support de titrage en utilisant la notation M2+ .
Q9)Quelle est la relation entre la quantité d'ions M2+ (nM2+) et la quantité d'ions Y4- (nY4-) ajoutés jusqu'à l'équivalence ?
Q10)Calculer la quantité nM2+. En déduire la concentration molaire volumique en ions calcium et magnésium de l'eau de Contrexéville.
1 degré hydrotimétrique français (1°TH) est égal à une concentration globale en ions calcium et magnésium de 10-4 mol.L-1 . On l’exprime aussi souvent en masse de ces ions par litre d’eau ou en masse équivalente de carbonate de calcium par litre d’eau.
Q11)Calculer le degré hydrotimétrique de l'eau de Contrexéville.
4- Vérification
L'étiquette de la bouteille indique en mg/L les concentrations massiques en ions calcium et magnésium : Ca2+ : 486 ; Mg2+ : 84.
Q12)A partir des données de l'étiquette, calculer le degré hydrotimétrique de l'eau de Contrexéville. Cette valeur est-elle en accord avec le résultat expérimental ?
Q13)Dresser l'inventaire des différentes erreurs expérimentales susceptibles d'expliquer la différence des résultats.
Masses molaires en g/mol : Ca : 40,1 ; Mg : 24,3 .
III/Exercices (à chercher)
1/Étude de l'efficacité d'une carafe filtrante
La dureté de l'eau ou titre hydrotimétrique (TH) est l'indicateur de la minéralisation de l'eau. Elle est surtout due aux ions calcium et magnésium. En France, le titre hydrotimétrique (TH) s'exprime en degré français (° ° f). 1 ° f correspond à 10-4 mol L-1 d'ions calcium (Ca2+ (aq)) et magnésium (Mg2+ (aq)).
Le tableau ci-après permet de caractériser la dureté d'une eau en fonction de son TH :
TH (°f) |
Oà7 |
7à15 |
15à25 |
25à42 |
supérieur |
Eau |
très douce |
douce |
moyennement dure |
dure |
très dure |
La dureté d'une eau se détermine grâce à un titrage complexométrique par l'EDTA, en présence d'un indicateur coloré de fin de réaction et d'une solution tampon permettant de maintenir le pH de la solution entre 9 et 10.
On souhaite donc comparer la dureté de l'eau du robinet (appelée eau n° 1) à celle obtenue après filtration avec une carafe filtrante (appelée eau n° 2). On réalise alors deux titrages :
un titrage d'un volume V= 20,0 mL d'eau n° 1 ;
un titrage d'un volume V= 20,0 mL d'eau n° 2.
La concentration de la solution d'EDTA utilisée est : c = 1,0 x 10-2 mol/L.
On note VE le volume (en mL) d'EDTA versé pour atteindre l'équivalence. Les résultats obtenus sont les suivants :
pour l'eau non filtrée (eau n° 1), VE = 6,7 mL;
pour l'eau filtrée (eau n° 2) : VE = 2,9 mL.
1/Quelle verrerie doit-on utiliser pour prélever le volume V= 20,0 mL d'eau à doser ?
2/Faire le schéma annoté du montage qui permet de réaliser le titrage.
En milieu basique, l'EDTA contient des ions Y4-(aq), qui réagissent avec les ions calcium (Ca2+ (aq)) et les ions magnésium (Mg2+ (aq)) selon les équations :
Ca2+(aq) + Y4-(aq) à[CaY]2-(aq)
Mg2+(aq) + Y4-(aq) à[MgY]2-(aq)
Cela signifie donc que la quantité d'EDTA versé sert à doser les quantités d'ions Ca2+ (aq) et Mg2+ (aq) présents dans le volume V d'eau titrée.
3/Si n(Ca2+) et n(Mg2+) désignent respectivement les quantités d'ions Ca2+ (aq) et Mg2+ (aq) présents dans le volume V d'eau titrée et si n(EDTA) désigne la quantité d'ions Y4- versés pour atteindre l'équivalence, quelle relation lie ces trois quantités ?
4/Quelle est la relation existant entre [Ca2+], [Mg2+],V,c et VE ?
5/Calculer, en mol/L, la valeur de la somme [Ca2+] + [Mg2+] pour l'eau n° 1 et l'eau n°2.
6/En déduire le TH exprimé en degré français (°f) de l'eau non filtrée (eau n°1) et celui de l'eau filtrée (eau n° 2).
7/Quelle est l'eau la plus dure ? Justifier.
8/Conclure sur l'efficacité de la carafe.
2/La verdunisation
L'eau de Javel, préparée depuis plus de deux siècles, reste l'un des produits désinfectants les plus efficaces contre les contaminations bactériennes et virales. C'est une solution aqueuse d'hypochlorite de sodium (Na+ + ClO-) et de chlorure de sodium (Na+ + Cl-) en milieu basique. L'ion hypochlorite, ClO-, est un désinfectant. Il possède cependant un pouvoir bactéricide assez faible, contrairement à l'acide hypochloreux HClO.
Dans le cas des désinfections d'eaux suspectes, le traitement anti-microbien peut utiliser l'eau de Javel, selon deux procédés :
-la javellisation .I.a quantité d'eau de Javel à ajouter est fonction de la contamination ou, grossièrement, du taux de matières organiques ;
-la verdunisation préconise des doses d'eau de Javel de dix à cinquante fois plus faibles, avec une efficacité démontrée.
La différence vient du protocole : dans le procédé de verdunisation, l'addition d'eau de Javel est réalisée lentement, avec un brassage vigoureux et prolongé. Ces conditions favorisent la dissolution du dioxyde de carbone, ce qui abaisse le pH et libère HClO, qui est plus efficace.
Le terme verdunisation provient de la première guerre mondiale, au cours de laquelle cette technique a été utilisée à grande échelle pour désinfecter l'eau de la Meuse consommée par les poilus de Verdun.
1/Pourquoi la dissolution du dioxyde de carbone abaisse-t- elle le pH d'une solution aqueuse ?
2/Pourquoi cette dissolution rend-elle la désinfection plus efficace ?
3/À partir de quelle valeur de pH la forme HClO est-elle favorisée ?
Données: pKa(CO2, H2O/HClO) =6,1; pKa(HClO/ClO-) = 7,5; pKa (H3O+/H2O).= 0.
Tp3 -spe ch - Traitement de l'eau : dureté et désinfection : Correction
I/Production d'eau de Javel :
1)
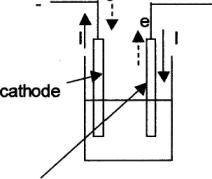
anode
2)- la phtaléine rosit , ce qui montre que le milieu devient basique (production d'ions HO) - l'indigo est décoloré (mise en évidence du dégagement de dichlore C12 )
3)L'ajout d'acide chlorhydrique provoque un dégagement gazeux de dichlore suite à la réaction de l'acide chlorhydrique avec les ions hypochlorite C10"
II/Dureté de l'eau :
4)Avant l'équivalence , la solution est rose . Après l'équivalence , elle est bleue .
5)Schéma du dosage :
6)L'équivalence est atteinte lorsque les réactifs ont été mélangés dans les proportions stoechiométriques de la réaction de titrage .
7)Veq=15 mL
8)M2+ + Y4- ---> [My]2‑
9)A l'équivalence : nm2+ = ny4-
10)nM2+= CY4- * Veq =10-2 * 15.10-3 = 15.10-5 mol.
CM2+ = nM2+/Veau = 15.10-5/10.10-3=15.10-3 mol/L =150.10-4 mol/L
1 degré hydrotimétrique français (1°TH) est égal à une concentration globale en ions calcium et magnésium de l0-4 mol/L . On l'exprime aussi souvent en masse de ces ions par litre d'eau ou en masse équivalente de carbonate de calcium par litre d'eau.
11)TH = 150 °f
4- Vérification
L'étiquette de la bouteille indique en mg/L les concentrations massiques en ions calcium et magnésium : Ca2+ : 486 ; Mg2+ : 84.
12)Les concentrations molaires correspondant aux titres massiques donnés sur l'étiquette sont :
Cca2+= tca2+ /Mca2+ = 0,486/40,1 =12,1.10-3 mol/L ; CMg2+ = tMg2+/ MMg2+ = 0,084/24,3 =3,45.10-3 mol/L d'où CM2+ = CCa2++ CMg2+ = 15,5.10-3 mol/L et finalement TH = 155 °f
La valeur trouvée à partir des titres donnés sur l'étiquette est voisine de la valeur expérimentale trouvée .
13)Les incertitudes expérimentales qui permettraient d'expliquer la différence des résultats peuvent être :
-l'incertitude sur l'appréciation du volume versé à l'équivalence .
-l'incertitude sur le volume d'eau prélevé .
-l'incertitude sur la concentration de l'EDTA qui a été préparé au laboratoire .