TP 2 Spe ch :Production d'eau potable - Traitement des eaux
I/L'eau douce sur terre :
Moins de 1% de toute l'eau présente sur terre est disponible pour les êtres vivants . Le risque de pénurie est élevé
II/L'eau potable :
Une eau potable est une eau que l’on peut boire sans risque pour la santé. Afin de définir précisément une eau potable, des normes ont été établies (OMS : organisation mondiale de la santé)qui fixent notamment les teneurs limites à ne pas dépasser pour un certain nombre de substances nocives et susceptibles d’être présentes dans l’eau. Le fait qu’une eau soit conforme aux normes, c’est-à-dire potable, ne signifie donc pas qu’elle soit exempte de matières polluantes, mais que leur concentration a été jugée suffisamment faible pour ne pas mettre en danger la santé du consommateur.
Le contrôle des espèces dissoutes est réalisé par des techniques analytiques : titrages colorimétriques , pH-métriques, conductimétriques etc…
Plusieurs méthodes permettent de produire de l'eau potable:
-A partir de l'eau douce : traitement industriel en plusieurs étapes (Nathan page 24)
-A partir de l'eau salée (Nathan pages 30 et 31)
Les eaux de surface et les eaux souterraines, dont les compositions en anions et en cations sont diverses, sont exploitées pour la production d'eau potable
III/Traitement des eaux :
Les eaux destinées à la consommation humaine et les eaux des rejets industriels sont soumis à des traitements physiques, chimiques ou physico-chimiques.
Certaines espèces chimiques doivent être éliminées parce qu'elles sont polluantes . Des traitements physico-chimiques sont alors mis en œuvre.
Les eaux usées sont collectées et acheminées à la station d'épuration où elles sont traitées.
IV/Titrage colorimétrique des ions chlorures :
La réglementation officielle fixe la concentration maximale en ions chlorure des eaux destinées à la consommation humaine à 250 mg/L. Il faut donc pouvoir déterminer la concentration en ions chlorure dans une eau de consommation.
A- Expériences préliminaires
1° expérience : dans un tube à essais, on introduit 1 mL d'une solution de chromate de potassium [2K+aq+ Cr042-aq] de concentration 10-2 mol/L et on verse quelques gouttes d'une solution de nitrate d'argent [(Ag+(aq)+ NO3-(aq)] de concentration 10-2 mol/L.
2° expérience : Dans un tube à essais, on verse 1 mL d'une solution de chlorure de sodium [Na+aq+ C1-aq] de concentration 10-2 mol/L et on verse quelques gouttes de la solution de nitrate d'argent.
3° expérience : Dans un tube à essais, on mélange 1 mL de la solution de chromate de potassium et 1 mL de la solution de chlorure de sodium. On verse goutte à goutte lentement la solution de nitrate d'argent.
Q1 - Noter les observations des trois expériences.
Q2-Ecrire les équations des réactions chimiques ayant lieu dans les deux premières expériences.
Q3)Quel précipité se forme en premier dans la troisième expérience ? Qu'observe-t-on lorsque l'on continue à ajouter la solution de nitrate d'argent ?
4° expérience :
On remplit la burette graduée, après l'avoir rincée, avec la même solution, d'une solution de nitrate d'argent.
Dans un bécher A, introduire un volume V1 = 5,0 mL de la solution de chlorure de sodium et un volume V = 4,0 mL de la solution de nitrate d'argent.
Dans un bécher B, introduire un volume V1 = 5,0 mL de la solution de chlorure de sodium et un volume V' = 6,0 mL de la solution de nitrate d'argent.
Verser ensuite dans chacun des béchers, un volume Vo= 0,5 mL de la solution de chromate de potassium . Agiter.
Q4-Noter les observations.
Q5-Avant l'ajout de la solution de chromate de potassium, déterminer lequel des deux réactifs est en excès dans chaque bêcher . Justifier le calcul.
Q6- Expliquer pourquoi le chromate de potassium peut être utilisé comme indicateur de fin de réaction lors du titrage des ions chlorure par les ions argent.
B/Titrage
1- Eau de Vichy St yorre
On dose un volume V = 10 mL d'eau de Vichy par la solution de nitrate d'argent précédente, de concentration C = 10-2 mol/L. L'indicateur de fin de réaction est constitué par quelques gouttes de la solution d'ions chromate, de concentration 0,05 mol/L.
Q7-Faire le schéma du dispositif expérimental.
Q8-Définir l'équivalence et indiquer le volume d'équivalence.
Q9- Ecrire l'équation de la réaction de titrage. Quelle relation lie, à l'équivalence, la quantité initiale d'ions chlorure et la quantité d'ions argent apportés ?
Q10-Calculer la concentration molaire volumique en ions chlorure de l'eau de Vichy.
Q11-Calculer la concentration massique volumique des ions chlorure de l'eau de Vichy en mg/L. M(Cl) = 35,5 g/mol
Q12-L'étiquette de la bouteille de Vichy St Yorre indique 322 mg/L. Comparer avec le résultat expérimental. L'eau de Vichy St Yorre respecte-t-elle la réglementation ?
2- Eau du robinet
Même manipulation avec 100 mL d'eau du robinet.
Q13-Noter le volume d'équivalence et en déduire la concentration massique volumique en ions chlorure de l'eau du robinet.
V/Exercices :
A chercher : 6 page 36 , 10 page 38 , 11 page 38
CORRECTION :
A- Expériences préliminaires
1)Expérience 1 :On obtient un précipité rouge de chromate d'argent Ag2CrO4
Expérience 2 : on obtient un précipité blanc de chlorure d'argent AgCl
Expérience 3: Le précipité de chlorure d’argent se forme en premier. Si l’on continue à ajouter la solution de nitrate d’argent, la couleur du précipité de chromate d’argent apparaît : ce précipité se forme dans un deuxième temps.
2)2 Ag+ + CrO42- ---> Ag2CrO4 pour la première expérience
Ag+ + Cl- ---> AgCl pour la seconde expérience
3)C'est AgCl qui se forme en premier et lorsqu'on continue à verser c'est un précipité de chromate d'argent qui se forme. On peut dire qu'il y a compétition entre la formation des deux précipités (les ions Ag+ peuvent réagir avec les ions chromate et les ions chlorure)
4)Dans le bêcher B se forme du chromate d'argent , ce qui n'est pas le cas avec le bêcher A
5)Avant d'ajouter le chromate de potasium , dans le bêcher A , nous avons CNaCl*V1 - CAgNO3*V = 10-2*5.10-3 - 4.10-3*10-2=10-5 mol d'ions Cl- puisque une partie des ions Cl- présents dans la solution de chlorure de sodium a précipité avec les ions Ag+ ajoutés qui ont tous réagi. Si on ajoute alors CK2CrO4*V0=0,5.10-3*1.10-2 = 5.10-6 mol de chromate de potassium , il est clair que celui-ci est en excès par rapport aux ion Ag+.
Dans le bêcher B on a ajouté davantage de nitrate d'argent et avant d'ajouter le chromate de potassium , nous avons dans ce bêcher : CAgNO3*V' - CNaCl*V1= 6.10-5 -5.10-5 = 1.10-5 moles d'ions Ag+ . Si nous ajoutons 0,5.10-5 moles d'ions chromate , comme n(Ag+)/2=0,5.10-5 = n(CrO4-), les deux réactifs sont dans les proportions stoechiométriques . Dès lors , si l'on continue à ajouter des ions dichromate dans le bêcher B , ces ions vont être en excès , alors qu'ils étaient en défaut dans le bêcher A.
6)Dans le bêcher A on a un précipité blanc , alors que dans le bêcher B, si on continue à ajouter du dichromate , la teinte rouge va persister . Autrement dit nous avons un changement de teinte lorsque change le réactif limitant . C'est la raison pour laquelle les ions dichromate peuvent servir d'indicateur de fin de réaction (changement de teinte à l'équivalence).
B/Titrage
7)
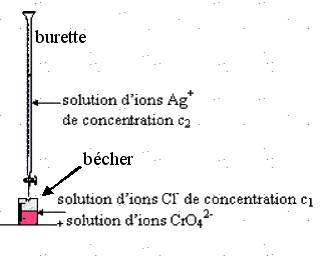
8)L'équivalence est atteinte lorsque les réactifs ont été mélangés dans les proportions stoechiométriques de l'équation de la réaction de titrage . Le volume de la solution de nitrate d'argent versé à l'équivalence est Veq = 9 mL
9)Ag+ + Cl- ---> AgClS
10)A l'équivalence n(Cl-)= n(Ag+ versés) ou Ccl-*V0=Cag+*Veq et donc : CCl-=10-2*9/10=9.10-3mol/l
11)t(Cl-)=CCl-*M(Cl)=9.10-3*35,5= 0,31 g/L=310 mg/L
12)La valeur trouvée du titre en ions Cl- est voisine de celle donnée sur l'étiquette à (322-310)*100/310=4% près.
La directive européenne 98/83 du 3 novembre 1998 qui est entrée en vigueur le 23 décembre 2003 fixe à 250 mg/l la teneur maximum en ion chlorure dans l'eau potable .Pour l'eau de Vichy , le titre en ions Cl- est supérieur à la norme . Autrement dit , l'eau de Vichy ne satisfait pas à cette norme .Cela signifie notamment qu'en cas de problèmes rénaux , il est préférable de ne pas en abuser !
2- Eau du robinet
Même manipulation avec 100 mL d'eau du robinet.
13)Pour 100 mL d'eau du robinet , on obtient Veq= 5 mL .
t(Cl-) =CCl-*M(Cl) = Cag+*Veq*M(Cl)/Veau = (10-2*5*35,5)/100 =1,8.10-2 g/L = 18 mg/L