
DEVOIR SURVEILLE DE PHYSIQUE-CHIMIE 1S10 (DS7) - 24/4/02
I/Dosage d'un déboucheur d'évier :
On souhaite déterminer par un dosage conductimétrique, la quantité de matière OH
- présente dans 1 L de déboucheur d'évier. La concentration de l'acide chlorhydrique utilisé est CA = 0,36 mol.L-1 .1/On dilue 200 fois le déboucheur et on obtient une solution appelée S . On verse de la solution S jusqu'au trait de jauge dans une fiole jaugée de 400 mL .
Faites le schéma de la fiole jaugée sur votre copie .
2/Le contenu de la fiole jaugée est versé dans un bécher . On suit ensuite l'évolution de la conductivité de la solution contenue dans le bécher en fonction du volume V d'acide chlorhydrique ajouté . Les valeurs de la conductance permettent de tracer le graphe ci-dessous :

a)Donnez l'équation-bilan du dosage entre les ions OH
- du déboucheur et les ions H3O+ de la solution d'acide chlorhydrique .b)Rappelez la définition de l'équivalence .
c)Déduire du graphe le volume V
eq à l'équivalence et calculer la quantité de matière n(H3O+) introduite à l'équivalence .d)Etablir un tableau d'avancement des réactifs à l'équivalence : on notera n(H
3O+) la quantité d'ions hydronium et n(OH-) la quantité d'ions hydroxyde introduites (état initial) . L'avancement maximal à l'équivalence sera noté Xm = Xeq .e)En justifiant clairement votre réponse , en déduire une expression littérale simple entre n(H
3O+) et n(OH-) .f)En déduire la concentration C
S,b en ions OH- de la solution S .g)Calculer la concentration C
B en ions OH- du déboucheur .II/Demi-équations électroniques :
a)Ecrire les demi-équations électroniques des couples :
1 - (Fe
3+/Fe2+)2- (MnO
4-/ Mn2+)3- (Cr
2O72-/Cr3+)4- (H
2O2/ O2)b)Pour chacun de ces couples préciser , en justifiant votre réponse , quel est l'oxydant .
c)Ecrire la réaction d'oxydo-réduction entre les ions fer II Fe
2+ et les ions permanganate MnO4-d)Quelles sont les couleurs des ions MnO
4- et des ions Mn2+ ?d)En déduire brièvement le mode opératoire qui permet de doser une solution d'ions Fe
2+ de concentration inconnue par une solution de permanganate de potassium de titre connu (les ions K+ sont incolores et la solution d'ions Fe2+ est très légèrement verdâtre) .III/Circuit électrique :
On réalise le circuit électrique dont le schéma est représenté ci-dessous :
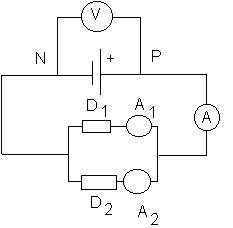
Reproduisez le schéma sur votre copie .
a)Indiquez sur le schéma , par deux flèches , le sens conventionnel du courant dans les dipôles D
1 et D2 . Justifiez votre réponse .b)Quel est le signe de la tension algébrique U
PN ? Représentez sur le schéma cette tension par une flèche .c)Les ampèremètres (A) et (A
1) , le voltmètre(V) indiquent des valeurs positives . Complétez le schéma en indiquant les positions des bones "COM" de ces appareils .d)L'ampèremètre (A) indique 1 A , l'ampèremètre (A
2) indique - 400 mA . Quelle est la valeur indiquée par l'ampèremètre (A1) ?
Correction :
I/Dosage d'un déboucheur d'évier :1)fiole jaugée :
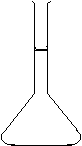
2-a) H3O+ + OH- --------> 2H2O
2-b)L'équivalence est atteinte lorsque les réactifs ont été mélangés dans les proportions stoechiométriques de l'équation-bilan , c'est à dire , ici , lorsque n(n(OH- initial) = n(H3O+ versés ).
2-c)A l'équivalence , la conductivité est minimale (voir TP C10) : le graphe donne Veq = 3 mL et donc n(H3O+ versés) = CaVeq = 0,36*3 10-3 = 1,08 10-3 mol .
2-d)
Equation chimique |
H3O+ + OH- ---------> 2H2O | |||
Etat du système |
Avancement (mol) |
Quantités de matière |
||
Etat initial |
0 |
n(H3O+) |
n(OH-) |
excès |
En cours de trans. |
X |
n(H3O+) - X |
n(OH-)- X |
excès |
Etat final |
Xeq |
n(H3O+) - Xeq=0 |
n(OH-) - Xeq = 0 |
excès |
2-e)La réaction de dosage étant totale et les réactifs ayant étant mélangés dans les proportions stoechiométriques de l'équation-bilan ( équivalence) , il ne reste plus de réactifs à l'état final et par conséquent : n(H3O+) - Xeq=0 et n(OH-) - Xeq = 0 . En éliminant Xeq de ces deux équations , nous obtenons : n(H3O+) = n(OH-)
2-f)De l'égalité précédente , nous déduisons : Ca Veq = Cb,s Vb avec Vb= 0,4 L , d'où Cb,s = 1,08 10-3/0,4 = 2,7 10-3 mol.L-1 .
2-g)Le déboucheur ayant été dilué 200 fois , la concentration en soude du déboucheur est CB= 0,54 mol.L-1 .
II/Demi-équations électroniques :
a) 1 - Fe3+ + e- = Fe2+
2 - MnO4- + 8 H+ + 5e- = Mn2+ + 4H2O
3- Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O
4- O2 + 2H+ + 2e- = H2O2
b)L'oxydant capte des électrons .
1 - Fe3+ ; 2- MnO4- ; 3- Cr2O72- ; 4 - O2
c)MnO4- + 8 H+ + 5e- = Mn2+ + 4H2O
Fe2+ = Fe3+ + e- | x 5
------------------------------------------------------
MnO4- + 8H+ + 5Fe2+ --------> Mn2+ + 5Fe3+ + 4H2O
d)Les ions MnO4- sont violets et les ions Mn2+ sont incolores .
e)On verse un volume déterminé de la solution d'ions Fe2+ dans un bécher : la solution a alors une teinte verdâtre .
La solution de permanganate de potassium dont la concentration molaire est connue est versée dans la burette graduée .
On verse de la solution de permanganate de potassium dans le bécher . Comme les ions MnO4- réagissent immédiatement avec les ions Fe2+ , la solution contenue dans le bécher reste verdâtre (les ions MnO4- violets ont été transformés en ions Mn2+ incolores) .
Si on continue à verser des ions MnO4- dans le bécher , lorsque tous les ions Fe2+ auront réagi (équivalence) , les ions MnO4- versés au-delà de l'équivalence et qui ne peuvent plus réagir , vont "imposer" leur coloration violette à la solution contenue dans le bécher . Autrement dit l'équivalence est atteinte dès que la coloration violette (à une goutte près) de la solution contenue dans le bécher persiste .
III/Circuit électrique :
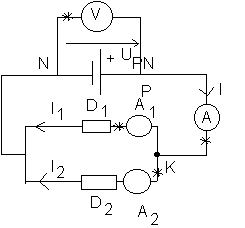
a)Les sens conventionnels des courants I1 et I2 sont représentés sur le schéma ci-dessus : A l'extérieur du générateur , le courant va du pôle positif vers le pôle négatif
b)UPN = VP - VN >0 : les potentiels diminuent lorsqu'on parcourt le circuit en passant du pôle positif au pôle négatif du générateur (voir TP 7). UPN est représentée sur le schéma .
c)Les bornes COM sont indiquées par " * " :
* Un ampèremètre mesure iA,com (valeur positive lorsque le courant "rentre" par la borne A) (voir TP6)
* Un voltmètre mesure Uv,com (valeur positive lorsque le potentiel de la borne "V" est plus élevé que celui de la borne "COM") (voir TP6) .
d)Nous appliquons la loi au noeud K : la somme des courants qui entrent au noeud est égale à la somme des courants qui sortent du noeud : I=I1 + I2 avec I2 = 400 mA et donc I1=600 mA .