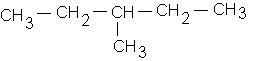
DEVOIR SURVEILLE DE CHIMIE - 1S10 (23/1/02)
Exercice 1 : Cellule de conductimétrie :
I/ A l'aide d'une cellule, on détermine la conductance d'une solution S
1 de chlorure de sodium NaCl de concentration c=5 10-3 mol.L-1 ; on trouve G=5,45 10-3 S .a)Ecrire la réaction de dissociation du chlorure de sodium dans l'eau .
b)La dissociation de NaCl est totale . Déterminer les concentrations en mol.L
-1 ,puis en mol.m-3 des ions Na+ et Cl- ([Na+] et [Cl-] ) dans la solution . La réponse sera clairement justifiée .c)On donne les conductivités molaires ioniques
l(Na+)= 3,87 10-3 .S.m2.mol-1 et l(Cl-)=7,63 10-3 S.m2.mol-1 . Déterminer la conductivité s de la solution .d) K= L/S (L: distance entre les électrodes , S surface immergée d'une électrode) est appelée "constante de cellule" . Déterminer K .
II/On dilue 10 fois la solution précédente (notée S
1) : on appelle S2 la solution obtenue .a)Proposez un mode opératoire qui permette d'obtenir 100 mL de S
2 à partir de la solution S1 .b)Quelles sont alors les concentrations des espèces ioniques présentes dans la solution S
2 ?On utilise le même cellule conductimétrique que précedemment pour mesurer la conductance de la solution S
2 .c)Déterminer la conductance de la solution S
2d)La tension aux bornes de la cellule est égale à 1 V . Calculer l'intensité I du courant qui traverse la cellule sachant que la constante de cellule est la même que précedemment .
Exercice 2 : Nomenclature:
1-Donnez les noms des espèces chimiques dont les formules sont représentées ci-dessous et représentez les formules topologiques correspondantes .
a)
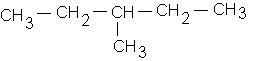
b)
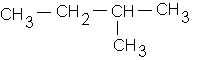
c)
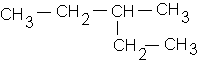
d)
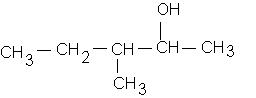
e)
![]()
2- Donnez les formules semi - développées des molécules dont les noms sont les suivants :
a) acide pentanoïque
b) butan-2-one
c) butan-2-ol
d) 3-méthylpentan-2-ol
3-Nommez et représentez les formules semi-développées des isomères du pentane .
Exercice 3 : Combustion complète de l'éthylène
On réalise la combustion d'un litre d'éthylène (ou éthène) de formule brute C
2H4 avec un volume V de dioxygène .1/Ecrire l'équation chimique de la combustion complète de l'éthylène (On rappelle qu'une réaction de combustion complète conduit à la formation de CO
2 et d'eau ) .2/Quel volume minimal V
de dioxygène doit-on utiliser pour qu'il ne reste plus d'éthylène après la combustion ?Donnée : Volume molaire des gaz dans les conditions de l'expérience V
M = 24 L.mol-1 .
correction :
Exercice 1:I/a)NaCl ---eau ----> Na+aq + Cl-aq
b)La dissociation étant totale , une mole de NaCl mise en solution apporte une mole d'ion Na+ et une mole d'ion Cl- dans la solution et par conséquent :
[Na+] = c = 5 10-3 mol.L-1 = 5 10-3 /10-3 = 5 mol.m-3 ( 1 L = 10-3 m3 )
[Cl-] = c = 5 10-3 mol.L-1 = 5 mol.m-3 .
c) s = l(Na+).[Na+] + l(Cl-).[Cl-] = 3,87 10-3 * 5 + 7,63 10-3 * 5 = 5,75 10-2 S.m-1 .
d) G=s*S/L = s/K et donc K=s/G = 5,75 10-2/5,45 10-3 = 10,5 m-1
II/a)Une dilution ne modifie pas le nombre de moles de soluté introduit : n=C.V = C'.V'
Pour préparer V'=100 mL de solution fille de concentration C'=C/10 , il faut prélever un volume V= C'.V'/C = V'/10 = 10 mL de solution mère . On prélève ces 10 mL avec une pipette jaugée munie d'une propipette , qu'on verse dans une fiole jaugée de 100 mL . Par ajouts successsifs en agitant entre deux ajouts , on verse de l'eau distillée jusqu'au trait de jauge . On agite enfin à nouveau pour obtenir une solution homogène .
b)Toutes les concentrations sont divisées par 10 :
[Na+] = c = 5 10-4 mol.L-1 = 0,5 mol.m-3
[Cl-] = c = 5 10-4 mol.L-1 = 0,5 mol.m-3 .
c)La conductance est également divisée par 10 G' = 5,45 10-4 S.
d)I=G'U = 5,45 10-4 *1 = 5,45 10-4 A = 545 µA
Exercice 2 :
1/-a : 3-méthylpentane ![]()
b : 2-méthylbutane :![]()
c: 3-méthylpentane ![]()
d: 3-méthylpentan-2-ol : 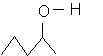
e: 2-chlorobut-1-ène : 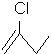
2/ a- acide pentanoïque
: 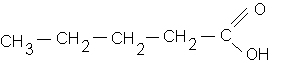
b: butan-2-one :
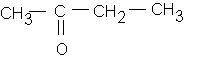
c: butan-2-ol
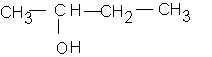
d: 3-méthylpentan-2-ol :
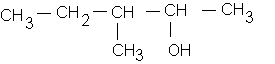
3/ Isomères du pentane :
a - le pentane
![]()
b- le 2-méthylbutane :
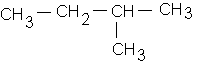
c: 2,2-diméthylpropane :
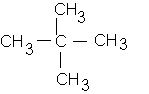
donc 3 isomères de chaîne autotal .
Exercice 3 :
1/ C2H4 + 3O2 --------> 2 CO2 + 2H2O
2/1 litre d'éthylène correspond à 1/24 = 0,042 mol d'éthylène . D'après l'équation-bilan il faut au moins 3 moles (proportions stoechiométriques) de dioxygène pour q'une mole d'éthylène réagisse totalement .
Ici , il faut par conséquent 3*0,042 = 0,125 mol de dioxygène , soit V=0,125 * VM= 3 L de dioxygène . C'est le volume minimal nécessaire de dioxygène pour que l'éthylène disparaisse complètement .