TP C8 : SENS D'EVOLUTION SPONTANEE D'UN SYSTEME CHIMIQUE
I/Le Problème posé :
Considérons 4 espèces A,B,C et D telles que A peut réagir avec B pour donner C et D ou C peut réagir avec D pour donner A et B .
Le modèle réactionnel correspondant peut donc s'écrire :
A + B = C + D (1)
Mélangeons nA,i moles de A , nB,i moles de B , nC,i moles de C et nD,i moles de D (L'indice i est utilisé pour désigner une quantité initiale) . Question : comment évoluera le système chimique ?
Différentes possibilités sont envisageables :
* Si les espèces introduites sont telles que Qr,i = Qr,eq = K , alors le système est dès le départ dans un état d'équilibre . Macroscopiquement , le système n'évoluera pas .
* Des espèces A et B peuvent réagir entre elles et disparaître au profit de C et D
* Des espèces C et D peuvent réagir entre elles et disparaître au profit de A et B
L' évolution est prévisible : un critère nous permettra de répondre à la question posée .
II/Cas d'une réaction acido-basique :
a)La réaction :
On étudie la réaction mettant en jeu 2 couples acide/base : HCOOH/HCOO- (pKa,1 = 3,8) et CH3COOH/CH3COO- (pKa,2 = 4,8).
Les 4 espèces sont mélangées . Sans préjuger du sens dans lequel se déroule la tansformation , l'équation de la réaction s'écrit :
HCOOH + CH3COO- = HCOO- + CH3COOH (1)
Q1)Ecrire le quotient de réaction Qr associé à cette réaction
Q2)L'équilibre chimique traduit par l'équation (1) n'est pas le seul susceptible d'exister lorsqu'on mélange les différentes espèces en solution aqueuse .Quelles sont les autres ?Ecrire les équations correspondantes et calculer leurs constantes d'équilibre .
La comparaison des valeurs des constantes d'équilibre permet de ne tenir compte que de l'équilibre (1) .
b)Quotients de réaction initiaux Qr,i
On utilise des solutions d'acide méthanoïque, d'acide éthanoïque, de méthanoate de sodium et d'éthanoate de sodium de même concentration C=0,1 mol.L-1 .
On prépare des solutions S et S' en mélangeant des volumes déterminés V1 d'acide méthanoïque, V2 de méthanoate de sodium , V3 d'acide éthanoïque et V4 d'éthanoate de sodium .
Q3)Montrer que
![]()
et
![]()
Q4)En déduire Qr,i en vonction des volumes versés .
La mesure du pH des mélanges permet de déterminer le rapport des espèces conjuguées à l'équilibre grace à la relation
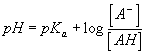
pour le couple AH/A- .
Q5)Déterminer les rapports  et
et 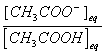 à l'équilibre en fonction du pH et du pKa
du couple .
à l'équilibre en fonction du pH et du pKa
du couple .
3)Mélanges :
Solution S : on mélange 10 mL de chacune des 4 solutions (volume total : 40 mL)
Solution S' : V1= 2 mL d'acide méthanoïque ; V2 = 10 mL de méthanoate de sodium ; V3= 20 mL d'acide éthanoïque et V4 = 2 mL d'éthanoate de sodium .
pH |
|
|
Qr,i |
|
|
Qr,f |
Qr,i/K |
|
sol S |
||||||||
sol S' |
Q6)Recopiez le tableau ci-dessus sur votre copie et complétez le .
Q7)Coparez Qr,f et K pour les deux mélanges
Q8)Comparez les rapports des espèces conjuguées à l'équilibre et à l'état initial et en déduire le sens de l'évolution de la réaction (1)
Q9)En considérant le rapport Qr,i/K peut-on prévoir le sens de l'évolution ? Détaillez votre réponse .
III/Cas d'une réaction d'oxydoréduction .
Solutions utilisées : chlorure de fer III de concentration C= 0,1 mol/L - sulfate de fer II , C= 0,1 mol/L -diiode de concentration C=10-3 mol/L - iodure de potassium C= 1 mol/L
On réalise les mélanges :
S1 : 5 mL de chlorure de fer III FeCl3 et 5 mL de sulfate de fer II FeSO4 (couple Fe3+/Fe2+)
S2 : 5 mL de diiode et 5 mL d'iodure de potassium (couple I2/I-).
On mélange S1 et S2 .
Q10)Qu'observez vous ?
Q11)Pour chacun des deux couples mentionnés ci-dessus , écrire les demi-équations électroniques correspondantes .
Q12)Ecrire la réaction rédox qui s'est produite lorsque vous avez mélangé S1 et S2 . Justifiez votre réponse à partir de votre observation (Q10)
Q13)Donnez l'expression du coefficient de réaction Qr associé à cette réaction .
Q14)Calculer Qr,i dans l'état initial .
Q15)La constante d'équilibre associée à cette réaction est K=5 107 . Comparer Qr,i à K . Le sens de l'évolution spontanée de la réaction était-il prévisible ?
TP C8 : correction
1)

2) HCOOH + H2O = HCOO- + H3O+ K = Ka = 10-3,8 = 1,58 10-4
HCOO- + H2O = HCOOH + OH- K= Ke/Ka = 6,4 10-11
CH3COOH + H2O = CH3COO- + H3O+ K = Ka = 10-4,8 =1,58 10-5
CH3COO- + H2O = CH3COOH + OH- K = Ke/Ka = 6,3 10-10
H2O + H2O = H3O+ + OH- K=Ke = 10-14
Pour la réaction (1) , la constante d'équilibre est K = Ka,1/Ka,2 = 10-3,8/10-4,8 = 10 . C'est à cette réaction que nous allons nous intéresser
3)Quantité d'acide méthanoïque introduite dans le mélange :
ni(HCOOH) = CV1
Concentration correspondante par rapport au mélange :[HCOOH]i = CV1/(V1+V2+V3+V4)
Quantité d'ions méthanoates introduits dans le mélange :
Remarquons tout d'abord que les ions méthanoates proviennent de la dissociation du méthanoate de sodium : HCOONa -----------eau--------> HCOO- + Na+ . Cette dissociation est totale (solution non saturée) et par conséquent , l'apport d'une mole de méthanoate de sodium se traduit par l'apport d'une mole d'ion HCOO-. Par conséquent ni(HCOO-) = CV2
Concentration correspondante par rapport au mélange :[HCOO-]i = CV2/(V1+V2+V3+V4)
Et par conséquent

L'autre relation se démontre de façon identique .
4)
![]()
5)


6)
pH |
|
|
Qr,i |
|
|
Qr,f |
Qr,i/K |
|
sol S |
4,3 |
1 |
1 |
1 |
3,16 |
0,31 |
10,2 |
0,1 |
sol S' |
4,1 |
5 |
0,1 |
50 |
2 |
0,2 |
10 |
5 |
7)Qr,f et K sont pratiquement égaux , ce qui est normal car Qr,f est le quotient de réaction à l'équilibre .
8) En se reportant au tableau , il est clair que :
* Pour la solution S :

Cela signifie qu'en évoluant vers l'état d'équilibre , la réaction s'est faite de gauche à droite
Le fait que
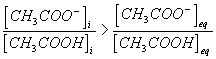
confirme le résultat établi précedemment .
* Pour la solution S' , la réaction s'est faite de droite à gauche .
9)Nous retiendrons :
* si Qr,i/K < 1 : la réaction a lieu de gauche à droite (sens direct)
* Si Qr,i/K >1 : la réaction a lieu de droite à gauche (sens inverse)
* Si Qr,i/K =1 : pas d'évolution macroscopique du système .
Ce que nous pouvons schématiser de la façon suivante :

10)La solution brunit ce qui montre expérimentalement que la quantité de diiode augmente dans le milieu réactionnel .
11)
Fe3+ + e = Fe2+
I2 + 2e = 2I-
12)
2Fe3+ + 2I- = I2 + 2Fe2+ : formation de diiode .
13)

14)

15)
