TP 7 :Détermination du pKa d’un indicateur coloré : Le bleu de Bromothymol
Le bleu de bromothymol est un composé organique qui existe sous deux formes :
• sa forme acide HIn est jaune en milieu aqueux
• sa base conjuguée In– est bleue en milieu aqueux
Q1 : Ecrire l'équation de la réaction entre HIn et l'eau. Donner l'expression de la constante d'acidité associée à cet équilibre.
But du TP : On déterminera dans une solution aqueuse de pH connu, la valeur du rapport ; ce rapport sera mesuré par spectrophotométrie d’absorption, on en déduira le pKa.
I – Principe de la détermination du rapport
La détermination du rapport se fait à partir des valeurs des absorbances des trois solutions suivantes, pour une longueur d’onde donnée.
Solution 1 |
Solution 2 |
Solution 3 |
BBT à pH connu (7) Solution verte Les deux formes colorées présentes le sont à des concentrations molaires du même ordre de grandeur. [HIn]1 + [In–]1 = C Absorbance A1 (ou A'1) |
BBT à pH = 1 solution jaune [In–]<<[HIn] Forme majoritaire : HIn [HIn]2 » C Absorbance A2 (ou A'2) |
BBT à pH = 13 solution bleue [HIn] << [In–] Forme majoritaire In– [In–]3 » C Absorbance A3 (ou A'3) |
II – Protocole opératoire
La solution de bleu de bromothymol est initialement à 0,4 g.L-1.
On prépare 100 mL de chacune des solutions suivantes :
| Solution S1 | Dans une fiole jaugée de 100 mL, rincée avec de l'eau de Volvic, introduire 1 mL de la solution de BBT. Compléter avec de l'eau de Volvic, homogénéiser. On obtient une solution verte S1 dont le pH est de 7,0. |
| Solution S2 | Dans une fiole jaugée de 100 mL rincée avec de l'acide chlorhydrique à 0,1 mol.L-1, introduire 1 mL de la solution de BBT. Compléter avec la solution d'acide chlorhydrique et homogénéiser. On obtient une solution jaune S2 dont le pH » 1. |
| Solution S3 | Dans une fiole jaugée de 100 mL rincée avec une solution de soude à 0,1 mol.L-1, introduire 1 mL de la solution de BBT. Compléter avec de la soude et homogénéiser. On obtient une solution bleue S3 dont le pH » 13. |
Pour chacune des trois solutions, on trace le spectre d'absorption A = f (l ) à l'aide du spectrophotomètre (spectre rapide).
Remarque: Le blanc réactif est fait en prenant pour S1 l'eau de Volvic de pH =7,0 ; en prenant pour S2, l'acide chlorhydrique à 0,1 mol.L-1; en prenant pour S3, la soude à 0,1 mol.L-1.
Q2 : Recopier l'allure des courbes d'absorbance de S1, S2, S3. Remplir le tableau suivant :
l 1 = 420 nm et l2 = 615 nm sont les 2 longueurs d'onde correspondant aux maxima d'absorption du BBT dans l'eau de Volvic (S1).
| Solution S1 | Solution S2 | Solution S3 | |
| l1 = 420 nm | A1 = | A2 = | A3 = |
| l2 = 615 nm | A'1 = | A'2 = | A'3 = |
III – Exploitation des graphes obtenus pour le calcul du pKA du BBT :
Appliquons la loi de Beer-Lambert à chacune des trois solutions, S1, S2, S3 :
• Pour l 1: A1 = eHIn l [HIn]1 + eIn- l [In-]1 A2 = eHIn l [HIn]2 A3 = eIn- l [In-]3
En utilisant les relations du § I : [HIn]1 + [In–]1 = C [HIn]2 » C [In–]3 » C on obtient :
A1 = [HIn]1 + [In-]1
A1 = [HIn]1 + ( C - [HIn]1 )
A1 = [HIn]1 ( - ) + A3 d'où
• Pour l2: A'1 = eHIn l [HIn]1 + eIn- l [In-]1 A'2 = e'HIn l [HIn]2 A'3 = e'In- l [In-]3
d'où A'1 = [HIn]1 + [In-]1
A'1 = ( C- [In-]1 ) + [In-]1
A'1 = [In-]1 ( - ) + A'2 d'où
donc
Or pH1 = pKa + log donc pKa = pH1 - log donc
Q3 : Calculer la valeur du pKa du BBT.
IV- DOMAINE DE PREDOMINANCE DES FORMES ACIDE ET BASIQUE :
On dispose d'une solution S constituée d'un mélange de plusieurs acides (solution de Britton-Robinson ): 12,5 mL d'acide phosphorique à 1,0 mol/L + 12,5 mL d'acide éthanoïque à 1,0 mol/L + 125 mL d'acide borique à 0,10 mol/L .On complète à un litre dans une fiole jaugée . Par ajout de différents volumes de soude, dans un volume donné de S, on obtient des solutions dont le pH varie régulièrement.
Dans des béchers numérotés de 1 à 8, verser 20,0 mL de solution S, ajouter le volume V de soude à 0,1 mol/L indiqué dans le tableau et agiter. Mesurer ensuite le pH et noter la couleur de la solution .
| n° | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| V (mL) | 10,0 | 9,0 | 8,0 | 7,0 | 6,0 | 5,0 | 4,0 | 3,0 |
| pH | ||||||||
| couleur |
Q4 : Tracer le diagramme de prédominance des formes acide et basique du BBT en fonction du pH. Inscrire sur ce diagramme la zone de virage observée ci-dessus.
Q5 : Calculer le rapport ![]() dans les béchers 1, 5 , 8.
dans les béchers 1, 5 , 8.
TP C7 : Correction :
1)HIn + H2O = H3O+ + In-
2)
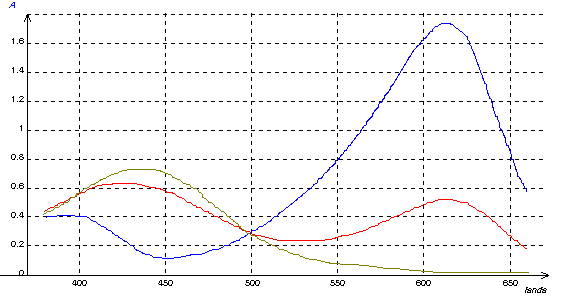
| Solution S1 | Solution S2 | Solution S3 | |
| l1 = 420 nm | A1 = 0,625 | A2 = 0,706 | A3 = 0,281 |
| l2 = 615 nm | A'1 = 0,525 | A'2 = 0,022 | A'3 = 1,74 |
3)
![]()
Les tables donnent : pKa = 7,3
4)
| n° | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| V (mL) | 10,0 | 9,0 | 8,0 | 7,0 | 6,0 | 5,0 | 4,0 | 3,0 |
| pH | 10 | 9 | 8 | 6,8 | 5,9 | 5,3 | 4,7 | 4,2 |
| couleur | bleu | bleu | bleu | bleu-vert | jaune-vert | jaune | jaune | jaune |
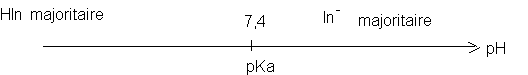
La zone de virage se situe manifestement dans l'intervalle :8-6
5) 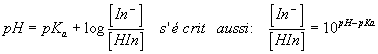
ce qui donne :
tube 1 : [In
-]/[HIn] = 1010-7,4= 400tube 5 : [In
-]/[HIn] = 0,03tube 8 : [In
-]/[HIn] = 6,3 10-4
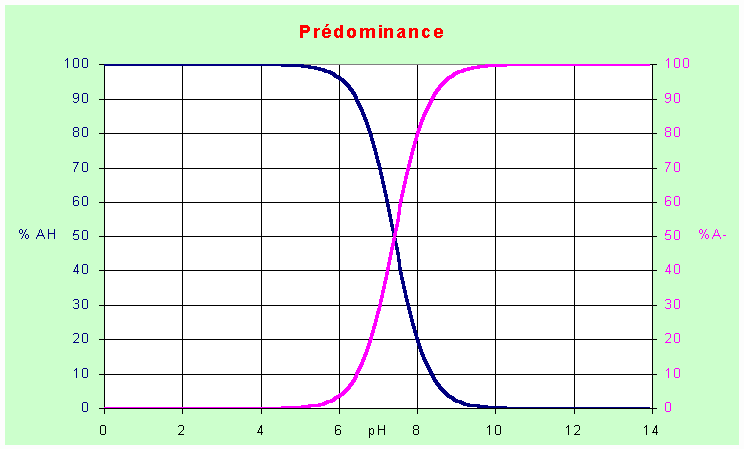
Le diagramme ci-dessus permet de retrouver ces valeurs :
tube 1 : 99,8/025 =400
tube 5 :3/96,9 =0,03
tube 8 : 0,063/99,93 = 6,3 10
-4 .Supplément : les formules
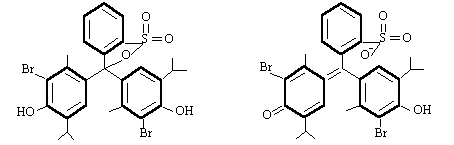
L'acide HIn La base In-