TP C5 :pKa d'un couple acide - base
Matériel:
Pipette 10 ml,éprouvette graduée,pH-mètre,bécher 100 ml ou erlenmeyer
Solutions décimolaires:
d'acide éthanoïque CH3COOH, d'éthanoate de sodium CH3COONa
I/Couple A/B étudié
A/B =CH3COOH/CH3COO-
Il est clair qu'on passe d'un élément du couple à l'autre en échangeant un proton suivant le schéma :
![]()
II/Objectif
Il s'agit de mélanger l'acide et sa base conjuguée de façon à pouvoir tracer la courbe pH = f(log[B]/[A]).
Nous mettrons ensuite en évidence l'existence d'une constante caractéristique du couple , constante que l'on notera pKa ( Ka : constante d'acidité) .
III/Préliminaires :
a)Espèces dans le mélange
Q1)Ecrire la réaction de l'acide éthanoïque avec l'eau . Recenser les espèces présentes dans la solution [Réaction 1].
L'éthanoate de sodium CH3COONa est un solide blanc constitué d'ions éthanoate CH3COO- et d'ions Na+ (solide ionique). Lorsqu'on le dissout dans l'eau , les ions se dispersent dans la solution suivant la réaction de dissociation :
CH3COONa --------> CH3COO- + Na+ (les ions sont hydratés)
Les ions Na+ ne réagissent pas (espèce inerte) . Les ions CH3COO- (base) réagissent par contre avec l'eau
Q2)Ecrire la réaction acido-basique entre l'eau et les ions éthanoate (la réaction est limitée) et recenser les espèces présentes dans la solution .
On mélange les deux solutions
Q3)Recenser les espèces présentes dans le mélange .
Q4)Ecrire les différentes réactions acido-basiques qui peuvent se produire dans le mélange
c)Approximations
L'ion éthanoate et l'acide éthanoïque réagissent faiblement avec l'eau (taux d'avancement final faible) et nous pouvons alors admettre que les nombres de moles d'acide éthanoïque et d'ions éthanoates présentes dans le mélange sont pratiquement égaux à ceux des quantités introduites .
Q5)On appelle CA et CB les concentrations des solutions initiales respectivement en acide éthanoïque et en ions éthanoate , et VA et VB les volumes utilisés pour réaliser le mélange .
Exprimer [CH3COOH] en fonction de CA , VA et VB . Exprimer [CH3COO-] en fonction de CB ,VA et VB .
Q6) Dans l'hypothèse où CA = CB (cas du TP
) , en déduire l'expression de 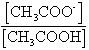 en fonction des volumes VA et VB .
en fonction des volumes VA et VB .
IV/Expérience
a)Mode opératoire
On réalisera différents mélanges de l'acide A et de sa base conjuguée B. Pour cela on utilisera de façon judicieuse la pipette de 10 ml et l'éprouvette graduée .
b)Mesures
VA (mL) |
10 |
20 |
30 |
40 |
50 |
VB (mL) |
50 |
40 |
30 |
20 |
10 |
pH |
|||||
lg(VB/VA) |
|||||
lg([CH3COO-]/[CH3COOH]) |
c)Courbe :
Q7)Tracer la courbe pH=f(lg([CH3COO-]/[CH3COOH])) en portant lg([CH3COO- ]/[CH3COOH]) en abscisse .
Q8)Quelle est la forme analytique de la fonction tracée ? Quels sont son ordonnée à l'origine et son coefficient directeur ?
Q9)Sachant que pH = pKa + lg ([CH3COO-]/[CH3COOH]) en déduire le pKa du couple étudié .
Q10)On pose pKa = - log Ka ( ou Ka= 10-pKa ). Montrer que la relation établie en Q8 est équivalente à : 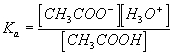
Q11)Comparer Ka à la constante d'équilibre de la réaction 1
CORRECTION DU TP :
1) CH3COOH + H2O = CH3COO- + H3O+
Les espèces présentes sont les espèces introduites et les espèces produites : CH3COOH , H2O , CH3COO- et H3O+ .
Signalons également la présence d'ions hydroxyde OH- qui résultent de l'autoprotolyse de l'eau :
H2O + H2O = H3O+ + OH-
2)CH3COO- + H2O = CH3COOH + OH-
espèces présentes : CH3COO- , H2O , CH3COOH , OH- , H3O+ et Na+
3)Espèces présentes dans le mélange : CH3COO- , H2O , CH3COOH , OH- , H3O+ et Na+
4)Les réactions qui peuvent se produire sont celles qui font intervenir chaque fois un acide et une base présente dans le mélange :
acides : CH3COOH du couple (CH3COOH/CH3COO-) , H3O+ du couple (H3O+/H2O) , H2O du couple (H2O/OH-)
bases : CH3COO- du couple (CH3COOH/CH3COO-) , OH- du couple (H2O/OH-) , H2O du couple (H3O+/H2O)
Les réactions qui peuvent se produire sont par conséquent :
* les réactions écrites ci-dessus à lire de gauche à droite ou de droite à gauche
* CH3COOH + CH3COO- = CH3COO- + CH3COOH
*H3O+ + H2O = H2O + H3O+ .
*H2O + OH- = OH- + H2O
Remarque : les ions Na+ sont inertes .
5)Suite à l'approximation proposée , nous pouvons écrire :
n(CH3COOH introduites) = n(CH3COOH dans le mélange)
CAVA = [CH3COOH] (VA + VB)
De la même façon , nous pouvons écrire pour les ions éthanoate :
CBVB = [CH3COO-] (VA + VB)
Remarque : Une mole de CHCOONa introduite se traduit par l'introduction d'une mole de CH3COO- .
6)En utilisant les expressions précédentes , nous obtenons :
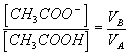
7)
| VA (mL) | 10 | 20 | 30 | 40 | 50 |
| VB (mL) | 50 | 40 | 30 | 20 | 10 |
| pH | 5,5 | 5 | 4,7 | 4,4 | 4 |
| lg(VB/VA) | 0,7 | 0,3 | 0 | -0,3 | -0,7 |
| lg([CH3COO-]/[CH3COOH]) | 0,7 | 0,3 | 0 | -0,3 | -0,7 |
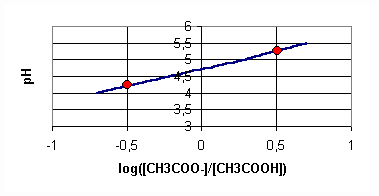
8)Nous obtenons une droite qui ne passe pas par l'origine (fonction affine) de la forme pH = ax + b en posant x= log([CH3COO-]/[CH3COOH]) .
L'ordonnée à l'origine est b= 4,7 , le coefficient directeur est a = DpH/Dx = (pH(M2) - pH(M1))/(x2-x1) =
(5,2 - 4,2)/(0,5 - (-0,5))=1
9) pKa= b = 4,7
10)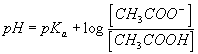 conduit à
conduit à 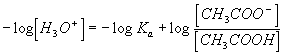 , soit en utilisant les propriétés de la fonction logarithme :
, soit en utilisant les propriétés de la fonction logarithme :
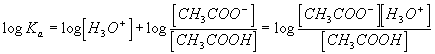 d'où finalement
d'où finalement
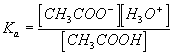 c.q.f.d.
c.q.f.d.
11)Ka = K(de la réaction 1) = Qr,eq