TPC1- VITESSE D'UNE REACTION CHIMIQUE
Matériel :
* solutions KI à 0,5 mol/L , Na
2S2O3,5H2O à 0,6 mol/L ,Na2S2O8 à 5 10-2 mol/L, empois d'amidon (ou thiodène)* verrerie : erlenmayer 200 mL , bécher , burette, éprouvette graduée 50 mL.
I)La réaction étudiée
Les ions iodure I- sont oxydés par les ions peroxodisulfate S2O82- :
S2O82- + 2 I- ------> 2 SO42- + I2 (1)
Avant l'étude quantitative de cette réaction, on mélangera un peu des deux solutions pour vérifier que la couleur marron de l'iode apparaît peu à peu.
En présence d'empois d'amidon, l'iode I2 formé donne immédiatement une coloration bleue ( à vérifier).
L'objectif du TP est de déterminer la quantité de I2 formée en fonction du temps. Pour cela nous allons utiliser une autre réaction qui servira de compteur : nous allons réduire le diiode I2 formé au début de la réaction par l'ion thiosulfate S2O32- :
2 S2O32- + I2 -----> S4O62- + 2 I- (2)
La réaction (1) est lente et la réaction (2) est très rapide. Il n'apparaît une coloration bleue (I2 en présence d'amidon) que si les ions thiosulfate ont disparu.
Le temps nécessaire à l'apparition de la coloration bleue permet de connaître la durée de la formation d'une quantité déterminée de diiode I2 par la réaction (1).
II/Etude de la réaction lente
On prépare 1 bécher A et un erlenmayer B:
bécher A: 30 mL de KI ; c=5.1O-1 mol.L -1 (pipette ou éprouvette graduée)
0,5 mL de Na2S2O3,5H2O ; c=0,6 mol.L-1 (burette)
10 gouttes d'empois d'amidon (ou une pincée de thiodène)
erlenmayer B: 30 mL de Na2S2O8 c=5.10-2 mol.L-1 (pipette ou éprouvette graduée)
Nous versons rapidement le contenu de A dans B et on déclenche le chronomètre.
Nous plaçons tout de suite l'erlenmayer contenant le mélange sous une burette qui contient une solution de thiosulfate (0,6 mol.L-1 ).
Au temps t1, le mélange A+B bleuit : nous notons ce temps t1. Ajoutons à nouveau avec la burette 0,5 mL de thiosulfate. etc...
Signification du temps t1 :Entre l'instant t=0 et l'instant t= t1tout le thiosulfate initialement introduit a été consommé par le diiode I2 formés par la réaction (1)
Le volume initial du milieu réactionnel 60 ml étant grand par rapport au volume de thiosulfate ajouté (5 ml), il est possible de considérer que le volume du système reste constant.
Q1)Faire l'expérience et compléter sur votre copie un tableau de la forme : (Durée de l'expérience : environ 40 mn )
t (mn) |
0 |
||||
V (mL) : thiosulfate consommé |
0 |
0,5 |
1 |
1,5 |
......... |
nb de moles de I 2 produits |
0 |
||||
[I 2] mol.L-1 formé par (1) |
0,5 |
III//Evolution temporelle de [I2]
Q2)Montrer que la quantité de matière de I2 formée à l'instant t par la réaction (1) est liée au volume V de thiosulfate consommé par la relation :
n(I2) = 0,3 10-3 V ( V en mL )
Q3)En déduire la relation entre [I2] et n(I2) dans la mesure où on peut considérer que le volume du mélange reste pratiquement constant ( 60 mL) .
Q4)Construire la courbe [I2] en fonction du temps t .
IV/Vitesse instantanée de formation du diiode :
a)définition de la vitesse instantanée:
![]()
(dérivée de [I2] par rapport au temps)
Pour déterminer pratiquement Vf(I2) à un instant t :
* tracer la tangente à [I2] =f(t) à l'instant t considéré
* Déterminer le coefficient directeur de la tangente : celui-ci est égal à Vf(I2)
b)Calculs :
Q5)Calculer les vitesses instantanées de formation de I2 aux instants t= 5 mn et t=30 mn . Comparer ces deux vitesses . Conclure.
Q6)Au cours de l'expérience, tenant compte de la méthode utilisée, que peut- on dire des concentrations des espèces réagissantes dans la réaction (1) ?
La vitesse de formation de I2 dépend t-elle de ces concentrations ?
V/Vitesse instantanée de disparition des ions iodures
a)définition de la vitesse instantanée:
![]()
Q7)Donner une interprétation géométrique de Vd(I-)
b)Vitesse de disparition et vitesse de formation :
Q8)Dans le cas de la réaction (1) étudiée , justifiez la relation :
vd(I-) = 2 Vf(I2)
Q9)Calculer Vd(I-) à t= 5 mn
VI/Vitesse de la réaction chimique (1)
a)Avancement de la réaction :
On considère une réaction dont l'équation-bilan s'écrit :
aA + bB ---> cC + d D
Soient n(A)i la quantité initiale de réactif A et n(A) la quantité de réactif A à l'instant t . On peut adopter une notation analogue pour le réactif B et les produits C et D.
On appelle "x" l'avancement de la réaction . Alors :
![]()
Remarque : n(A) = [A] . V où V est le volume de la solution
b)vitesse de la réaction
![]()
v est la vitesse de la réaction
Q10)Quelle est l'untité de v lorsque V est exprimé en litres et le temps t en secondes?Que devient cette unité si le temps est exprimé en mn ?
c)Cas de la réaction étudiée :
Q11)Tracer x/V = g(t) pour la réaction (1) étudiée
Q12)Donnez une interprétation géométrique de v . Calculer v à l'instant t=5 mn
Q13)Etablir une relation entre v et Vf(I2) ainsi qu'une relation entre v et Vd(I-)
VII/Temps de demi-réaction :
a)Définition :
Le temps de demi-réaction t1/2 correspond à la durée nécessaire pour que l'avancement de la réaction soit parvenu à la moitié de sa valeur finale.
b)Calcul
Q14)Déterminer t1/2 pour la réaction (1)
TP C2 : Correction :
1)
t (mn) |
0 |
2,1 |
4,5 |
7 |
10 |
13,8 |
18 |
23,6 |
32 |
44 |
V (mL) |
0 |
0,5 |
1 |
1,5 |
2 |
2,5 |
3 |
3,5 |
4 |
4,5 |
n(I 2) en mmol |
0 |
0,15 |
0,3 |
0,45 |
0,6 |
0,75 |
0,9 |
1,05 |
1,2 |
1,35 |
[I 2] en mmol/L |
0 |
2,5 |
5 |
7,5 |
10 |
12,5 |
15 |
17,5 |
20 |
22,5 |
2)Le diiode qui réagit avec les ions thiosulfate provient de la réaction (1) . D'après l'équation-bilan (2) :
![]()
Or n(S2O32- ayant réagi) = C. V , où C est la concentration de la solution de thiosulfate (en mol/L) et V le volume de solution de thiosulfate versé ( en L) et donc :
n(S2O32- ayant réagi) = 0,6* V
Finalement : n(I2 formé) = 0,6/2*V . Si on exprime V en mL il faudra écrire , en posant n(I2)=n(I2 formé) :
n(I2) = 0,3 .10-3 * V
3)[I2] = n[I2] /Vsolution = n(I2)/60 10-3
4)
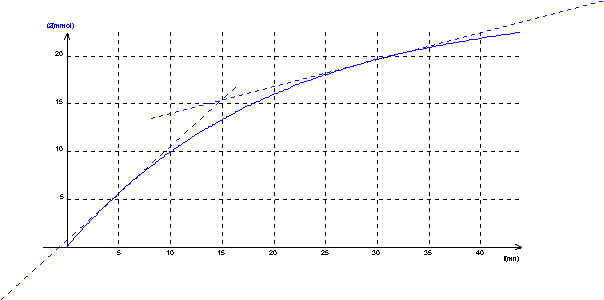
5)Pour calculer les vitesses instantanées on trace les tangentes à la courbe aux instants considérés et on calcule leurs coefficients directeurs :
* à t= 5 mn Vf(I2)= 1 10-3 mol.L-1.min-1
* à t= 30 mn : Vf(I2) = 0,28 10-3 mol.L-1.min-1
Il est clair que la vitesse de formation de I2 est plus importante à t= 5 mn qu'à t=30 mn .
6) *La concentration en I- est pratiquement constante car les ions I- sont régénérés par la réaction (2) .
* La concentration en ions peroxodisulfate S2O82- par contre diminue , car ils sont consommés par la réaction (1)
D'après les conclusions établies dans la question précédente , on peut affirmer que Vf(I2) dépend de la concentration en solution des ions peroxodisulfate : La vitesse diminue lorsque la concentration diminue .
7)Vd(I-) est égale à l'opposé du coefficient directeur de la tangente à la courbe [I-] =g(t) à l'instant considéré .
8)D'après l'équation-bilan ,pendant que la réaction (1) produit une mole de diiode , la réaction a consommé le double de moles de I- , c'est a dire 2 . La vitesse de disparition de I- est donc le double de la vitesse de formation de I2 :
Vd(I-) = 2 Vf(I2)
9)A t= 5 mn Vd(I-) = 2*1 10-3 = 2 10-3 mol.L-1.min-1 .
10)v s'exprime en mol.L-1.s-1 . Si le temps est exprimé en mn , alors v s'exprime en mol.L-1.min-1 .
11) ![]()
Autrement dit , la courbe à tracer est identique à [I2] = f(t) précedemment tracée .
12) 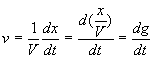
v est donc égale au coefficient directeur de la tangente à g(t) à l'instant t considéré .
A t= 5 mn v = 10-3 mol.L-1.min-1
13)v =Vf(I2) et v = Vd(I-)/2
14) La réaction sera terminée lorsque tous les ions peroxodisulfate auront réagi :
Or n(S2O82-)i = 5 10-2 * 30 10-3 = 1,5 10-3 mol = 1,5 mmol
n(S2O82-)final = 0 mmol
et donc ![]()
La réaction (1) s'effectuant à volume constant , la durée au bout de laquelle x=xfinal/2 est la même que celle pour laquelle nous avons x/V = xfinal/2V . Nous pouvons donc utiliser la courbe g(t) pour déterminer t1/2 .
xfinal/2V = 1,5 10-3 / 120 10-3 = 12,5 mmol/L
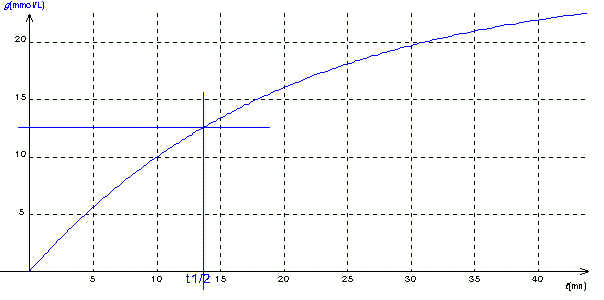
De la courbe nous déduisons t1/2 = 14 mn .