
* Réaliser une synthèse organique en suivant un protocole expérimental
* Séparer et purifier le produit préparé par cristallisation
* Expliquer les différentes étapes du mode opératoire
* Calculer le rendement
II/Matériel et réactifs :
a)Matériel
* un ballon de 250 mL * une cuvette
* un bec bunsen * un agitateur en verre
* une pissette d'eau distillée * un thermomètre
* une pipette * cristallisoir
* glace * filtration simple + büchner
* bécher 50 mL
b)Réactifs :
* acide sulfurique concentré * alcool absolu 95 °
* 5 g d'acide salicylique
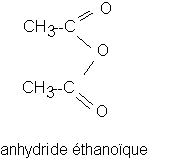
* 7 cm3 d'anhydride acétique ( M= 102 g.mol-1 , d= 1,08) . L'anhydride acétique est dans une burette placée sous la hotte (enlever le bouchon à la partie supérieure de la burette avant de se servir ).
III/Mode opératoire
a)Hémi-synthèse de l'acide salicylique

* Dans le ballon bien sec, mettre les 5 g d'acide salicylique .
* Ajouter doucement 7 cm3 d'anhydride acétique et mélanger avec l'agitateur en verre . ATTENTION : l'ahydride éthanoïque est très irritant pour les yeux . Il faut éviter d'en respirer et de le toucher avec les doigts .
* Avec la pipette ajouter 3 gouttes d'acide sulfurique concentré .
* Chauffer à reflux ,pendant 15 à 20 minutes ,ce mélange maintenu au bain marie à 50 - 60 °C .
Q1)Donnez les formules semi-développées de l'acide salicylique, de l'anhydride éthanoïque et de l'aspirine . Encadrez et nommez les groupes fonctionnels rencontrés dans ces trois corps .
Q2)Ecrire l'équation-bilan de la réaction correspondant à la synthèse de l'acide acétylsalicylique . Précisez les caractéristiques de cette réaction .
Q3)Pourquoi utilise t-on l'anhydride éthanoïque et non l'acide éthanoïque pur pour effectuer cette synthèse ?
Q4)Calculer le nombre de moles de réactifs utilisés .Un des réactifs est-il enexcès ? si oui, pourquoi ?
* Le ballon étant encore chaud , ajouter avec précautions (lunettes) par le sommet du réfrigérant 75 mL d'eau distillée (utiliser un verre à pied) en plusieurs fois .
Terminer en brassant vigoureusement le contenu du ballon à l'aide de l'agitateur en verre . L'aspirine brute précipite sous forme de cristaux blancs .
* Filtrer l'aspirine (filtration simple :entonnoir + filtre ) et la rincer avec un peu d'eau . Mettre le papier filtre à plat de façon à récupérer le mieux possible le précipité (avec une spatule si nécessaire) .
Q5)Pourquoi ajoute t-on de l'eau à la fin de la réaction ?
Q6)Ecrire l'équation-bilan de la réaction entre l'anhydride éthanoïque restant et l'eau .
b)Purification de l'acide acétyl salicylique .
On purifie cette aspirine par recristallisation .
* Remettre le précipité dans le ballon avec 15 cm3 d'éthanol à 95 ° .
* Chauffer au bain marie avec précaution jusqu'à dissolution totale du précipité en agitant .
* Ajouter alors environ 40 cm 3 d'eau chaude à 60 °C (on prendra de l'eau du bain marie) . Agiter en chauffant éventuellement au bain marie jusqu'à ce que la solution redevienne limpide .
Laisser refroidir une quinzaine de minutes sans agiter . Finir le refroidissement dans un cristallisoir qui contient de l'eau glacée . - Ne jamais présenter le visage à l'ouverture du ballon ! L'aspirine purifiée cristallise lentement .
Q7)Quel est le principe de la recristallisation ?
Q8)Pourquoi doit-on utiliser le minimum d'éthanol pour pour dissoudre l'acide acétylsalicilique ?
Q9)Quelle quantité (en masse) d'acide acétylsalicylique pourriez vous espérer obtenir si le rendement de la réaction était de 100 %?
* Verser le contenu du ballon sur le filtre Büchner .Régler le robinet de façon à ce que l'aspiration soit légère . Rincer les cristaux avec un peu d'eau froide avant de les étaler sur un papier filtre .
* Déterminer par pesée la masse d'acide acétylsalicylique obtenu , une fois les cristaux secs .
Q10)Quel est le rendement effectif de cette synthèse ?
TP C12 : correction
1)

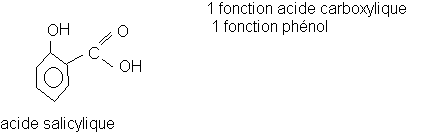
2)
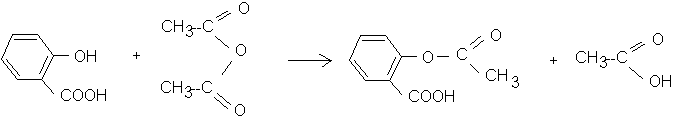
La réaction est relativement rapide (comparativement à la réaction d'estérification) , totale et exothermique .
3)On utilise l'anhydride au lieu de l'acide pour cette réaction car l'anhydride est plus réactif que l'acide
4)
* acide salicylique : C7H6O3 . M= 7*12+6+3*16= 138 g.mol-1
n = m/M = 5/138 = 3,6 10-2 mol .
* anhydride éthanoïque
d = r/reau donne r = 1*1,08 = 1,08 kg.L-1 = 1080 g.L-1 .
Manhydride = 4*12+3*16+6= 102 g.mol-1
n=m/Manhydride = rV/Manhydride = 1080*7.10-3/102=7,4 10-2 mol
La réaction se faisant mole à mole , il est clair que l'anhydride est en excès . On préfère mettre l'anhydride en excès car celui-ci coûte environ 3 fois moins cher que l'acide salicylique .
5)On ajoute de l'eau à la fin de la réaction pour transformer l'anhydride en excès en acide éthanoïque
6)

7)Principe de la recristallisation : on joue sur la différence de solubilité entre le composé à recristalliser (ici l'aspirine) et ses impuretés (acide salicylique n'ayant pas réagi et acide éthanoïque) dans un solvant .
L'acide salicylique est très soluble dans l'éthanol et peu soluble dans l'eau . L'acide éthanoïque est par contre très miscible à l'eau . L'aspirine quant à elle , est très soluble dans l'éthanol mais très peu soluble dans l'eau à froid .
Il est donc clair , qu'ici l'éthanol permet de dissoudre l'aspirine et les impuretés restantes . L'ajout d'eau et le refroidissement provoquent dans ce mélange essentiellement la cristallisation de l'aspirine que l'on va ensuite pouvoir filtrer .
http://www.sciences-en-ligne.com/lic/chimie/chi_exp/materiel/montages/recristallisation.htm
8)L'acide acétylsalicylique (aspirine) étant très soluble dans l'éthanol , il ne précipite pas si le volume d'éthanol est trop important par rapport au volume d'eau ajouté .
9)L'acide salicylique est le réactif limitant . L'équation de la réaction nous permet d'affirmer que si la réaction était totale (disparition totale du réactif limitant), on obtiendrait 3,6 10-2 mol d'aspirine , soit une masse de 3,6 10-2*180 = 6,48 g .
10)On obtient environ 4 g d'aspirine , ce qui correspond à un rendement r= 4/6,48 = 61 %
Rappel : rendement r
![]()