TP C2 - SPECTROPHOTOMETRIE
I/But du TP
- realiser un spectre de solution coloree
- sliivre l'evolution d'une reaction lente
- comparer des vitesses de reaction
II/ - Spectre d'absorption
On utilise une solution tres diluee de permanganate de potassium
Q1) Represenler le spedre A = f(l) et indiquer la valeur de A au pic d'absorplion maximale
III/Etalonnage du spectrophotomètre :
a)Réalisation de solutions de diiode de concentrations connues
S1 : sol I2 à 2 10-2 mol.L-1
S2 : sol KI (K++ I-) à 0,1 mol/L
S3 : sol acide sulfurique H2SO4 à 1 mol/L
L'étalonnnage est réalisé en utilisant des solutions de diiode I2 de concentration connue .
| N° | V de I2(mL) | V de KI (mL) | V acide (mL) | eau distillée | [I2] mmol/L | A |
| 0 | 0 | 15 | 15 | 20 | ||
| 1 | 5 | 15 | 15 | 15 | ||
| 2 | 8 | 15 | 15 | 12 | ||
| 3 | 10 | 15 | 15 | 10 | ||
| 4 | 12 | 15 | 15 | 8 | ||
| 5 | 15 | 15 | 15 | 5 | ||
| 6 | 20 | 15 | 15 | 0 |
Q2)Reproduisez le tableau sur votre copie et complétez la colonne " [I2] "
b)Absorbance des solutions précédentes :
On règle le spectrophotomètre sur la longueur d'onde l= 490 nm .
Q3)Complétez le tableau en inscrivant les différentes mesures de l'absorbance A effectuées avec le spectrophotomètre .
Q4)Représentez sur votre copie A=f([I2]). En déduire que f est une fonction linéaire dont on déterminera le coefficient directeur k , tel que A=k.[I2]
IV /Suivi d'une transformation
a)La reaction entre l'eau oxygénée H2O et les ions iodure
Les deux couples rédox mis en jeu sont (H2O2/H2O) et (I2/I-)
Q5)Ecrire les demi-équations électroniques relatives à ces deux couples en en déduire l'équation de la réaction qui modélise la transformation chimique entre l'eau oxygénée et les ions iodure .
b)Réglage du zéro du spectrophotomètre .
Pour régler le zéro du spectrophotomètre , on utilise le mélange constitué de :
* 10 mL d'acide sulfurique
* 18 mL de solution de KI
* 2 mL d'eau distillée.
c)Suivi de la réaction :
Mélange réactionnel :
* 10 mL d'acide sulfurique
* 18 mL de solution de KI
* 2 mL d'eau oxygénée à 0,1 mol/L.
L'objectif est de suivre l'évolution temporelle de la transformation envisagée ci-dessus . Le spectrophotomètre va nous permettre de suivre cette évolution .
Q6)Parmi les quatre espèces mentionnées dans les couples énumérés dans IV/a, quelle est l 'espèce qui permet d'effectuer un suivi spectrophotométrique de la réaction envisagée ?Justifiez votre réponse .
d)Evolution de la concentration en diiode en fonction du temps :
A partir du bureau de l'ordinateur , ouvrir le dossier "Spectro" et lancer le fichier "sp2002"
Le fichier chargé contient les mesures effectuées par le spectrophotomètre .
Nous voulons utiliser Regressi pour :
* Calculer la concentration c =[I2] à partir de l'absorbance A mesurée par le spectrophotomètre , sachant que c= A/k , k étant la constante déterminée dans Q4 .
* Tracer c en fonction du temps
1- Calcul de c :
* Afficher la fenêtre GRANDEURS (Reg 1)
* Créer la grandeur c=A/k (Reg 2) . Attention il faut utiliser la valeur numérique de k !
2-Tracé de c=f(t)
*Afficher la fenêtre GRAPHE (Reg 3)
*Afficher la courbe c=f(t) (Reg 4)
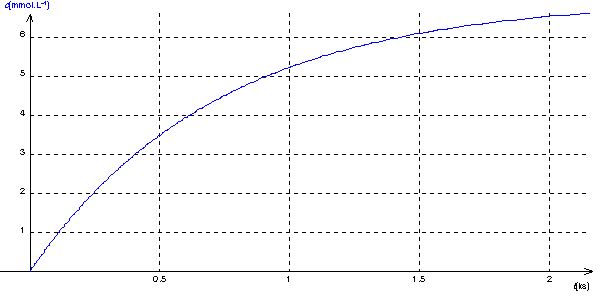
Q7)Représentez sur votre copie l'allure de la courbe obtenue
e)vitesse de la réaction :
![]()
est ici , la vitesse de la réaction considérée
Q8)Comment déterminer graphiquement, à une date déterminée, la vitesse v ?
Curseur standart / curseur tangente
sélectionner "Tangente simple"
Q10)"ballader" le curseur de la souris sur la courbe et reproduisez le tableau suivant sur votre copie en le complétant .
| t en s | 0 | 500 | 1000 | 1500 |
| v en .......... |
TP C1 : Correction :
1)
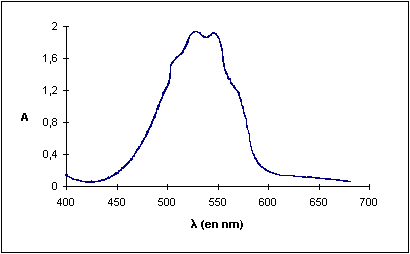
Il apparaît que le permanganate absorbe essentiellement à des longueurs d'onde comprises entre 540 et 550 nm : cela correspond à du jaune-vert (voir livre de physique page 53) . Or cette couleur est précisément complémentaire du violet (jaune-bleu) . Cela permet d'expliquer la couleur violette du permanganate ( violet = blanc - jaune/vert) .
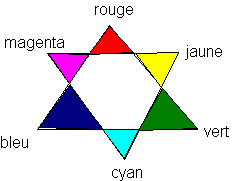
Deux couleurs opposées sont complémentaires
2)
| N° | V de I2(mL) | V de KI (mL) | V acide (mL) | eau distillée | [I2] mmol/L | A |
| 0 | 0 | 15 | 15 | 20 | 0 | 0 |
| 1 | 5 | 15 | 15 | 15 | 2 | 0,6 |
| 2 | 8 | 15 | 15 | 12 | 3,2 | 0,9 |
| 3 | 10 | 15 | 15 | 10 | 4 | 1,1 |
| 4 | 12 | 15 | 15 | 8 | 4,8 | 1,3 |
| 5 | 15 | 15 | 15 | 5 | 6 | 1,7 |
| 6 | 20 | 15 | 15 | 0 | 8 | 2,2 |
3)voir tableau ci-dessus
4) A est une fonction linéaire de [I2] . Son coefficient directeur est k = 275 L.mol-1 .
5)
H2O2 + 2H+ + 2e- = 2H2O
2I- = I2 + 2e-
------------------------------------------------
H2O2 + 2I- + 2H+ --------> I2 + 2H2O (1)
Cette équation modélise la transformation chimique lorsqu'on mélange l'acide sulfurique (10 mL d'acide molaire) , la solution d'iodure de potassium (18 mL de solution KI décimolaire) et de l'eau oxygénée (2 mL de solution à 0,1 mol.L-1)
6)C'est I2 , la seule substance colorée dans le mileu réactionnel, qui permet le suivi spectrophotométrique de la réaction (1) : L'absobance mesurée est proportionnelle à [I2] .
7)
8)![]()
D'après l'égalité (2) , la vitesse v de la réaction est égale au coefficient directeur de la tangente à c(t) à l'instant considéré .
9)
| t en s | 0 | 500 | 1000 | 1500 |
| V en mmol/L/s. | 9,6 10-3 | 4,8 10-3 | 2,4 10-3 | 1,2 10-3 |