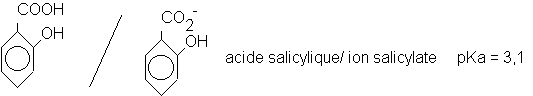
Données utiles :
Couples acide – base :
CH3COOH / CH3CO2- acide éthanoïque/ ion éthanoate pKa = 4,8
Zone de virage de la phénolphtaléine : 8,2 – 10
Masse molaire de l’aspirine M = 180 g/mol
M(H) = 1g/mol M(O) = 16 g/mol.
1. Sur la notice de ce médicament on lit :
Indications thérapeutiques
: Ce médicament est de l’aspirine, mais ce dosage, seul ou associé aux autres traitements prescrits par votre médecin,.est plus particulièrement destiné au traitement de certaines affections du cœur ou des vaisseaux.1.1. Citer d’autres indications thérapeutiques de l’aspirine.
1.2. On donne ci-dessous la formule semi-développée de l’acide acétylsalicylique ou aspirine :
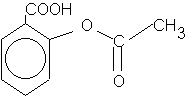
Indiquer quelles sont les fonctions chimiques présentes dans cette molécule.
2. On se propose de vérifier par un dosage la masse d’acide acétylsalicylique contenue dans une gélule " UPSA 325 ".
On fait réagir à chaud une solution concentrée et en excès d’hydroxyde de sodium sur l’acide acétylsalicylique contenu dans la gélule. La réaction est traduite par l’équation-bilan (1):
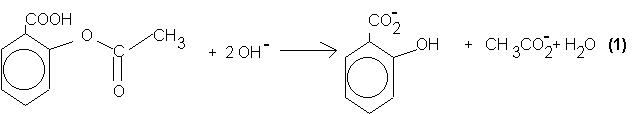
2.1. Quel est le site électrophile mis en jeu lors de la réaction de saponification ? Justifier la réponse.
2.2. Quelle est la propriété de l’ion hydroxyde ainsi mise en évidence ? Justifier la réponse.
3. Protocole expérimental.
* Etape 1 :
On introduit le contenu d’une gélule " UPSA 325 " dans un erlenmeyer contenant un volume Vb = 20,0 mL de solution d’hydroxyde de sodium de concentration Cb = 0,500 mol/L. On chauffe à reflux le mélange pendant environ quinze minutes à l’aide d’un agitateur magnétique chauffant.
3.1. Faire un schéma annoté du dispositif expérimental utilisé pour le chauffage à reflux.
3.2. Pourquoi doit-on chauffer le mélange réactionnel ?
* Etape 2 :
Après refroidissement de la solution, on la verse dans une fiole jaugée de capacité 100 mL et on complète au trait de jauge avec de l’eau distillée. On note (S) la solution obtenue.
On dose 25,0 mL de la solution (S) avec une solution d’acide chlorhydrique de concentration C
a = 1, 00. 10-1 mol/L en présence de quelques gouttes de phénolphtaléïne.Au changement de teinte de l’indicateur le volume d’acide versé est Va = 16,0 mL.
3.3. Calculer la quantité de matière n
1 d’ions hydroxyde initialement présents dans les 20,0 mL de solution d’hydroxyde de sodium.3.4. Ecrire l’équation-bilan (2) de cette réaction de dosage des ions OH- en excès.
3.5. Calculer la quantité de matière n
2 d’ions OH- en excès dans les 25,0 mL de solution (S).3.6. En déduire la quantité de matière puis la masse d’acide acétylsalicylique contenues dans la gélule.
La masse trouvée est-elle en accord avec le nom du médicament ?
3.7. La solution (S) contient trois bases. Les identifier et les classer par force décroissante.
Trois réactions sont possibles quand on ajoute des ions H3O+ Laquelle est prépondérante?Correspond-elle au dosage étudié ?
Justifier le choix de la phénolphtaléine pour ce dosage.
Corrigé :
1.1. L’aspirine est un :
Antipyrétique ( ou fébrifuge) : fait tomber la fièvre.
Antalgique : calme la douleur
Analgésique : rend insensible à la douleur
1.2.
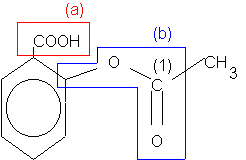
La molécule d’aspirine possède les fonctions :
* Acide carboxylique ( présence du groupe carboxyle
-COOH (a)
*Ester , présence du groupe : |
|
2.1. Le site électrophile mis en jeu lors de la réaction de saponification est l’atome de carbone C (1) du groupe fonctionnel ester.
L’atome d’oxygène est plus électronégatif que l’atome de carbone ; les liaisons C- O et C = O sont polarisées. Il apparaît des charges partielles positives sur l’atome de carbone et négatives sur les atomes d’oxygène.
|
L’atome de carbone présente un déficit d’électrons,il est donc avide d’électrons ; c’est un site électrophile |
2.2. La saponification correspond à l’attaque du réactif nucléophile OH- sur le site électrophile du groupement ester.
Schéma de Lewis de l’ion hydroxyde :
![]()
L’atome d’oxygène possède trois doublets non liants ; il est donc riche en électrons : c’est un
site nucléophile.3.1 .
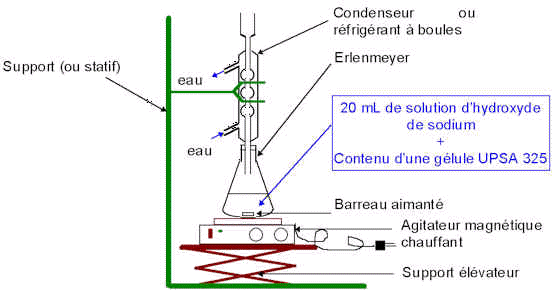
3.2. L’aspirine est à la fois un acide et un ester ; l’ion hydroxyde est à la fois une base et un réactif nucléophile.
L’action des ions hydroxyde sur l’aspirine met donc en jeu deux types de réactions chimiques :
¨ une réaction
acido-basique entre les ions OH- et le groupe carboxyle COOH ; cette réaction est rapide et totale.¨ une réaction de
saponification entre les ions OH- et le groupe ester. Cette réaction est lente et totale.La température étant un facteur cinétique, elle permet d’accélérer la réaction de saponification.
3.3. Quantité de matière n1 d’ions hydroxyde initialement présents :
n1 = Cb. Vb n1 = 0,500 x 20,0.10-3 = 1,00. 10-2 mol
n1 = 1,00. 10-2 mol
3.4. Equation-bilan (2) de la réaction de dosage des ions OH- restant en excès :
![]()
3.5. A l’équivalence les réactifs ont été introduits dans les proportions stoechiométriques ; d’après l’équation-bilan (2) :
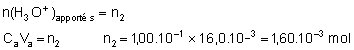
3.6. Quantité de matière d’ions OH- restants dans la solution (S) :
n3 = 4 n2 n3 = 1,60.10-3´ 4 = 6,40.10-3 mol
Quantité de matière d’ions hydroxyde ayant réagi avec l’aspirine selon l’eéquation-bilan (1) :
n = n1 – n3 n = 1,00.10-2 – 6,40.10-3 = 3,60.10-3 mol
D’après les proportions stoechiométriques de l’équation-bilan de la réaction (1) :
![]()
naspirine = 1,80.10-3 mol
Masse d’aspirine contenue dans la gélule :
![]()
m = 324 mg
Ce résultat est en accord avec la teneur en acide acétylsalicylique indiquée sur la notice (325 mg).
Ecart relatif entre ces deux valeurs :
![]()
3.7. Avant dosage la solution (S) contient 3 bases : La base forte OH- et 2 bases faibles
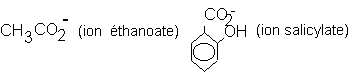
Lorsqu’on introduit les ions H3O+ , trois réactions acide-base sont possibles, mais c’est la réaction entre l’acide le plus fort (H3O+) et la base la plus forte (OH-) qui se produit d’abord (réaction prépondérante).
![]()
réaction (2)
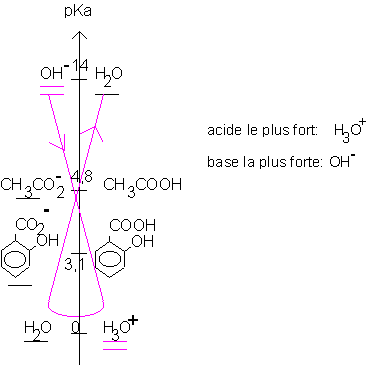
A l’équivalence de la réaction (2) entre l’acide fort et la base forte, la solution contient encore les 2 bases faibles :

Son pH est donc supérieur à 7.
L’indicateur coloré phénolphtaléine convient car son virage correspond à la fin du dosage des ions OH- en excès, les deux autres bases n’ayant pas encore réagi.
------------------------------------------------------------------------------------------------------------
Auteur : Académie de Poitiers
Code de l'exercice : 98LGB045
Discipline :
Chimie
Partie de la discipline :
Chimie organique
Niveau et série :
T S
Capacités à évaluer :
C2 - Capacités expérimentales
Savoir utiliser le matériel figurant au programme
Savoir schématiser une expérience
C4 - Modèles et paramètres
Savoir identifier les paramètres jouant un rôle dans les phénomènes physiques ou chimiques
Types d'exercices :
De type baccalauréat
A caractère expérimental
Types d'aides :
Pas d'aide
Mots-Clés : Aspirine/Dosage par différence/Electrophile/Nucléophile/Saponification.
Niveau de difficulté :
2 - Moyen
Résumé :
98LGB045: Chimie - Chimie organique - T S.
Capacités à évaluer : Capacités expérimentales/ Modèles et paramètres.
Type d'exercice et d'aide : De type baccalauréat A caractère expérimental sans Aide .
Mots-Clés : Aspirine/Dosage par différence/Electrophile/Nucléophile/Saponification.
Aspirine UPSA 325
-------------------------------------------------------------------------------------------------------------