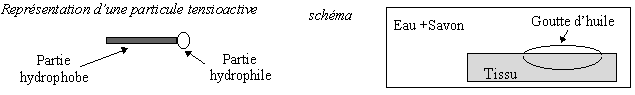
Document N°1 : Le savon.
" Le savon est un produit chimique ? Mais, non, c’est un produit naturel, connu depuis l’Antiquité! ". et pourtant, quel collégien n’a pas pâli sur la réaction de saponification :
huile ou graisse + alcali(1) savon + glycérine(2)
qui est à la base de fabrication des savons ... depuis l’origine des temps. /...../
Le savon de Marseille :
Il se fabrique dans de grandes cuves, en plusieurs étapes.
La saponification met en présence le corps gras chauffé et fondu et la lessive de soude
(3) à 50% environ. Au début, la réaction est lente car les constituants ne sont pas miscibles, mais au cours du temps, la formation de savon facilite le mélange, et la réaction tend à s’emballer. En fin de saponification, on ajoute du sel et, on soutire la solution aqueuse de glycérine.Extrait : " Molécules " septembre 1980
(1) alcali : hydroxyde d’un métal alcalin .Exemples: hydroxyde de sodium, hydroxyde de potassium
(2) glycérine, ou glycérol, en nomenclature officielle propan-1,2,3-triol
(3) lessive de soude, solution aqueuse d’hydroxyde de sodium
Document N°2.
Comment laver plus blanc que blanc ? Les poudres détergentes modernes sont des mélanges compliqués de nombreux composants, parmi lesquels figurent en bonne place les " surfactants ",appelés aussi tensioactifs, dont fait partie le banal savon. Il s’agit de molécules dont une extrémité est hydrophile tandis que l’autre est hydrophobe. Ce caractère amphiphile (amphi = les deux, philos = amour) fait que les surfactants tendent à se placer aux interfaces entre l’eau et l’huile. C’est cette propriété qui permet de faire disparaître les tâches de gras .
Extrait : " La Recherche N°284" Février 1996
Questions:
I - a) Écrire la formule semi-développée de la glycérine.
- b) Indiquer le ou les groupes fonctionnels contenus dans la molécule de glycérine.
- c) la molécule de glycérine est-elle chirale ? Justifier la réponse
II - a) Donner la formule générale d’un acide carboxylique en mettant en évidence le groupe fonctionnel.
- b) Qu’est-ce-qu’un corps gras ?
Donner la formule générale d’un corps gras en mettant en évidence le ou les groupes fonctionnels.
III - a) Écrire l’équation bilan de saponification d’un corps gras.
- b) Pourquoi cette réaction est-elle lente au départ ?
- c) Quel est l’intérêt du chauffage ?
- d) Pourquoi ajoute-t-on du sel en fin de réaction ?
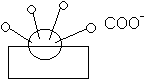
IV - Le savon est un tensioactif.
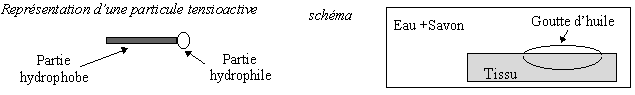
- a) Définir les termes hydrophile et hydrophobe.
- b) Indiquer la partie hydrophile et la partie hydrophobe d’un ion carboxylate du savon.
- c) Préciser, sur le schéma, comment s’orientent les particules du tensioactif.
V - Données: numéro atomique : hydrogène (Z = 1), oxygène (Z = 8 ), carbone (Z = 6)
- a) Donner la représentation de Lewis de l’ion hydroxyde.
- b) Donner la représentation de Lewis du groupe fonctionnel ester.
- c) Avec quelle partie de la molécule d’ester l’ion hydroxyde réagit-il lors de la première étape de la saponification ?
CORRECTION :
I/a-
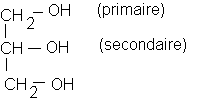
b-la molécule de glycérine (ou glycérol) contient trois fonctions alcool : deux primaires et une secondaire)
c)La molécule n'est pas chirale (aucun carbone n'est porteur de quatre groupements différents)
II/a- R-COOH (groupe fonctionnel : COOH)
b)corps gras : tri-ester du glycérol et d'un acide gras .
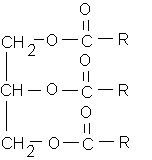 3 fonctions ester
3 fonctions ester
III/-a : Equation bilan de la saponification d'un corps gras :
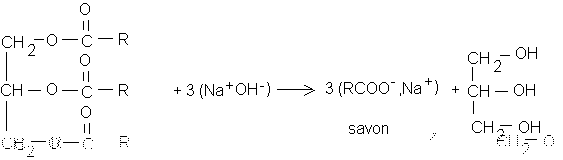
b)La réaction est lente au départ car le contact entre les réactifs n'est pas bon (non miscibles)
c)En chauffant , on augmente la température du milieu réactionnel et la vitesse de formation des produits , dont le savon , est ainsi plus élevée .
d)A la fin , on fait une opération de relargage : ajout de solution salée , ce qui favorise la précipitation du savon .
IV/-a : hydrophile :qui présente une affinité pour l'eau
hydrophobe : qui présente une répulsion pour l'eau .
b)Partie hydrophobe : R
Partie hydrophile : COO-
c)
V/-a :modèle de Lewis de l'ion hydroxyde
![]()
b)Modèle de Lewis du groupement ester
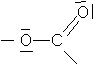
c)Lors de la première étape de la saponification , un site nucléophile de l'ion hydroxyde (doublets libres) réagit avec le site électrophile du carbone fonctionnel du groupement ester .