Dosage colorimétrique - Autocatalyse
Pour étudier , à température constante et en milieu acide , la cinétique de la réaction entre l'ion permanganate MnO
4- et l'acide oxalique H2C2O4 , on réalise l'expérience suivante :A la date t=0 , on mélange rapidement, en présence d'un excès d'acide sulfurique, 40 mL d'une solution aqueuse (S
1) de permanganate de potassium de concentration C1 = 5.10-3 mol.L-1 et 60 mL d'une solution aqueuse (S2) d'acide oxalique de concentration C2 = 5.10-2 mol.L-1 .La couleur d'une solution contenant des ions permanganate dépend fortement de la concentration de ces ions . On utilise cette propriété pour déterminer la concentration [MnO
4-]à chaque instant1/Réaction étudiée
L'équation bilan de la réaction s'écrit :
2 MnO
4- + 5 H2C2O4 + 6 H3O+ ------> 2 Mn2+ + 10 CO2 + 14 H2O (1)Les couples d'oxydoréduction qui interviennent sont MnO
4- / Mn2+ et CO2 /H2C2O4 .Ecrire les demi-équations d'oxydo-réduction correspondant aux couples précédents .
2/Préparation des solutions
On dispose :
- de la verrerie suivante : éprouvettes graduées de 10 mL; burette graduée de 25 mL ; pipettes jaugées de 1 mL , 5 mL, 10 mL ; fioles jaugées de 100 mL , 500 mL ; béchers .
- des produits suivants : solution de permanganate de potassium à 0,1 mol.L
-1 ; solution aqueuse d'acide oxalique à 5.10-2 mol.L-1 acidifiée à l'acide sulfurique ; eau distillée .a)Décrire par des schémas clairs et assortis de légendes précises la manipulation permettant de fabriquer 100 mL de la solution S
1 .b)Calculer en moles la quantité n
1 d'ions permanganate présents à t=0 dans le milieu réactionnel .c)Quelle est en moles la quantité stoechiométrique n
2 d'acide oxalique c'est à dire nécessaire pour réduire au bout d'un temps assez long tous les ions permanganate ? En a t-on suffisamment introduit dans le milieu réactionnel ?3/Expérience
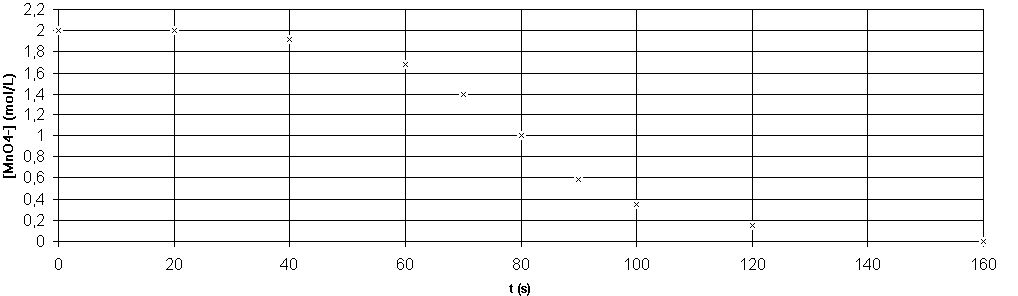
L'étude colorimétrique donne les résultats suivants :
t (s) |
0 |
20 |
40 |
60 |
70 |
80 |
90 |
100 |
120 |
160 |
[MnO 4-] (mol.L-1) |
2 |
2 |
1,92 |
1,68 |
1,4 |
1 |
0,59 |
0,35 |
0,15 |
0 |
Ces résultats sont portés sur la courbe ci-après :

a)Définir la vitesse instantanée de disparition des ions MnO
4- . Déterminer la valeur de cette vitesse à l'instant t= 80 s .b)Comment varie la vitesse de disparitions des ions MnO
4- au cours de l'expérience .c)Une propriété assez générale en cinétique chimique est que la vitesse de disparition des réactifs diminue quand les concentrations de ceux-ci diminuent .
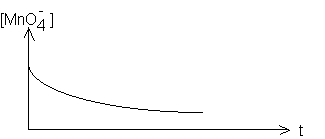
1-Cette propriété vous parait-elle vérifiée dans l'expérience envisagée ?
2-Quelle serait l'allure de la courbe si tel était le cas ?
d)Comment expliquer l'allure de la courbe obtenue ?
CORRECTION :
1- MnO4- + 8 H+ + 5e = Mn2+ + 4H2O
H2C2O4 = 2CO2 + 2H+ + 2e
2-a :On veut préparer 100 mL de solution S1 à 5.10-3 mol.L-1 , à partir d'une solution 10-1 mol.L-1 = 100 10-3 mol.L-1 de permanganate de potassium : il faut donc diluer 20 fois .
Mode opératoire :
* prélever 5 mL de la solution mère avec une pipette jaugée de 5 mL, munie d'une propipette.
* Verser dans une fiole jaugée de 100 mL
* Ajouter de l'eau distillée en plusieurs fois en prenant soin d'agiter et enfin compléter , toujours avec de l'eau distillée jusqu'au trait de jauge . Agiter de façon à rendre bien homogène la solution obtenue .
2-b:n1 = C1V1= 2.10-4 mol .
2-c : D'après l'équation-bilan , les réactifs sont dans les proportions stoecchiométriques si :
n1/2 = n2/5 d'où n2 = 5/2 n1= 5.10-4 mol.
Or , on a introduit dans le milieu réactionnel C2V2 = 30.10-4 mol d'acide oxalique : l'acide oxalique introduit est bien en excès .
3 -a : Vitesse instanténée de disparition des ions permanganate :
![]() . Celle-ci est
représentée par l'opposé du coefficient directeur de la tangente à la courbe à
l'instant considéré .
. Celle-ci est
représentée par l'opposé du coefficient directeur de la tangente à la courbe à
l'instant considéré .
![]()
b-En suivant l'évolution du coefficient directeur à la tangente à la courbe au cours du temps , on constate que la valeur absolue de celui-ci :
* est faible au début (tangente pratiquement parallèle à l'axe "t") : vitesse faible .
*augmente ensuite assez rapidement à partir de la date t=40 s environ , ce qui correspond donc à une augmentation de la vitesse de disparition des ions MnO4- .
* diminue ensuite (à partir de 100 s environ) pour tendre vers zéro (réaction terminée , vitesse nulle)
c-1 :La propriété énoncée n'est pas vérifiée dans l'expérience .
c-2 : si tel était le cas , la courbe ressemblerait à :
d)L'allure de la courbe s'explique si on admet que l'une des espèces formées catalyse (autocatalyse car le catalyseur est produit par la réaction elle-même) la réaction .
On peut confirmer expérimentalement que ce sont les ions Mn2+ qui catalysent la réaction .