Préparer du paracétamol, purifier le produit brut et identifier le paracétamol formé.
II. PRÉPARATION
1. Principe
Elle est réalisée à partir d’un composé A de formule (CH3 - CO)2 O et du 1-amino-4-hydroxybenzène selon la réaction d’équation-bilan (1) :
(CH3 - CO)2 O + NH2 - C6H4
- OH ![]() CH3 - CO - NH - C6H4
- OH + CH3 - CO2H (1)
CH3 - CO - NH - C6H4
- OH + CH3 - CO2H (1)
Cette réaction est exothermique.
2. Protocole opératoire
tableau de données
état physique 25 °C, 1 bar |
densité |
température de fusion en °C |
température d’ébullition sous 1 bar en °C |
||||
1-amino-4-hydroxybenzène |
solide |
186 |
|||||
composé A |
liquide |
1,08 |
- 73 |
136 |
|||
acide éthanoïque |
liquide |
1,03 |
118 |
||||
paracétamol |
solide |
171 |
|||||
Les masses molaires atomiques exprimées en g.mol-1 : M(H) = 1 ; M(C) = 12 ; M(N) = 14 ; M(O) = 16
Dans un erlenmeyer, on introduit successivement une masse m = 2,8 g de 1-amino-4-hydroxybenzène, 25 cm3 d’eau et 2 cm3 d’acide acétique pur. L’erlenmeyer est placé dans un bain marie à 80 °C et le mélange réactionnel est agité jusqu’à la dissolution complète.
Après avoir refroidi le mélange, on introduit lentement un volume V = 3,5 cm3 du composé A mesuré à l’éprouvette, tout en agitant.
En plaçant l’erlenmeyer dans un bain d’eau glacée, le paracétamol formé, ou paracétamol brut (PB), précipite sous forme de cristaux. Après filtration, lavage avec un peu d’eau et séchage, on pèse le paracétamol brut (PB) obtenu. Sa masse m1 est égale à 3,2 g
III. RECRISTALLISATIONLes cristaux de paracétamol brut sont ensuite dissous dans 20 cm3 d’eau bouillante. La solution est ensuite refroidie dans de la glace jusqu’à la cristallisation, aussi complète que possible, du paracétamol recristallisé (PR).
Après filtration, lavage à l’eau et séchage en étuve, on pèse le paracétamol recristallisé (PR). Sa masse m’1 est égale à 2,01 g.
IV. CHROMATOGRAPHIE
On réalise une chromatographie du paracétamol recristallisé (1) et de paracétamol pharmaceutique (2) avec pour éluant, un mélange (60 et 40 % en volume respectivement ) de dichlorométhane et d’éthanol.
On obtient le chromatogramme suivant :
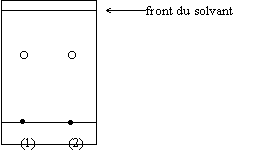
Note technique à l’attention du professeur : selon le mode d’impression du fichier informatique, les points peuvent se trouver décalés : les aligner correctement avant reproduction.
QUESTIONS
1. Donner le nom et la formule semi-développée du composé A. Donner également le nom et la formule du produit de la réaction qui accompagne la formation de paracétamol.
2. L’attaque nucléophile intervenant dans la réaction de formation du paracétamol, entre les deux réactifs, est symbolisée par la flèche ci-dessous :
Représenter les structures de Lewis de ces deux composés et indiquer les sites électrophile et nucléophile qui sont concernés dans cette réaction de formation du paracétamol.
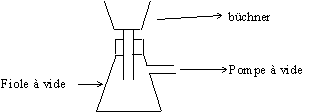
3. Faire le schéma annoté du montage de filtration sous vide du paracétamol.
4. Après la préparation du paracétamol brut, on réalise une recristallisation. Quel est l’intérêt d’effectuer cette opération ?
5. Interpréter le chromatogramme obtenu.
6. Donner le nom d’un procédé simple, autre que la chromatographie, que l’on peut utiliser pour identifier le paracétamol formé.
7. a. Calculer les quantités de matière des réactifs introduits. Quel est le réactif en excès ?
b. Pourquoi peut-on utiliser des éprouvettes graduées pour mesurer les volumes de l’acide éthanoïque et du composé A ?
Calculer la masse de paracétamol que l’on peut théoriquement obtenir. Calculer le rendement de la réaction en paracétamol recristallisé.
CORRECTION :
1. Le nom du composé A est l’anhydride éthanoïque ; sa formule semi-développée est :
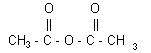
Le produit de la réaction qui accompagne la formation du paracétamol est l’acide éthanoïque. Sa formule semi-développée est :
![]()
2. Les représentations de Lewis des composés sont :
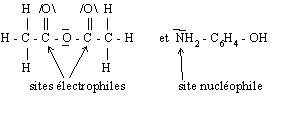
3. Schéma du montage de filtration sous vide
4. La recristallisation permet la purification du produit en éliminant un certain nombre d’impuretés.
5. Il n’y a qu’une seule tache. Il s’agit donc d’un produit pur. C’est du paracétamol puisque sa tache se trouve à la même distance de la ligne de base de celle du paracétamol pharmaceutique.
6. Détermination de la température de fusion du composé recristallisé (au banc Köfler par exemple).
7. a. Les quantités de matière des composés A et C6H7NO introduites dans le milieu réactionnel sont :
nintroduit (A) = ![]() =
= ![]() = 3,7 . 10-2
mol.L-1
= 3,7 . 10-2
mol.L-1
nintroduit (C6H7NO) = ![]() = 2,6 . 10-2 mol
= 2,6 . 10-2 mol
D’après l'équation-bilan (1), la relation stoechiométrique est :
nayant réagi (A) = nayant réagi (C6H7NO)
On constate que le composé A est introduit en excès.
7. b. Le composé A étant introduit en excès, son volume peut donc être mesuré à l’éprouvette graduée. L’acide éthanoïque n’est pas un réactif de la réaction, son volume peut lui aussi être mesuré à l’éprouvette graduée.
8. La masse de paracétamol que l’on peut obtenir théoriquement est égale à m = nformé (C8H9 NO2) . M
avec nformé (C8 H9 NO2) = nintroduit ( C6H7NO) = 2,6 . 10-2 mol
soit m = 3,93 g
Le rendement est alors égal à r = ![]() = 0,51 ou 51 %
= 0,51 ou 51 %