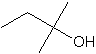TP TS - SPECTROSCOPIE INFRAROUGE
1°)Principe :
La spectroscopie infrarouge (IR) est une technique qui permet danalyser des solides, des liquides ou des gaz.
Dans lindustrie, elle est appliquée pour effectuer les contrôles de qualité dans lagroalimentaire ou pour la recherche des polluants dans latmosphère. On lutilise également pour identifier des espèces chimiques synthétisées au laboratoire, ou pour identifier les pigments dune uvre dart.
Les molécules sous leffet des rayons IR peuvent subir des mouvements de vibrations ; ainsi elles peuvent être le siège doscillations de la longueur de liaison (vibration délongation)
![]()
ou/et doscillations de langle de liaison (vibration de déformation).
Lancer le logiciel SPECAMP (Bureau bis\logiciels\specamp )
►On peut "visualiser" ces vibrations grâce au logiciel dans le bandeau supérieur
![]() sélectionner .
sélectionner . ![]()
Choisir alors dans le cadre en bas à droite le type de vibration et visualiser
les différentes possibilités et lire lencadré des explications.
Les rayonnements IR peuvent provoquer ces vibrations pour peu que leurs fréquences correspondent aux fréquences de vibration de la molécule ou dune partie de la molécule. Les rayonnements correspondant sont alors absorbés par la molécule. Létude dun spectre IR rend compte des radiations absorbées, ce qui permet danalyse les groupes fonctionnels contenus dans la molécule.
2°)Différence Transmittance/ Absorbance :
▪Dans le bandeau supérieur cliquer sur loutil A/T. Dans la partie droite de la fenêtre, cliquer sur Charger un spectre IR .
Dans la fenêtre qui s'ouvre , ouvrir le repertoire "OH" puis sélectionner "IR_1-propanol.jdx".
Si elle
ne l'est pas , sur le coté droit de la fenêtre , sélectionner l'option
"les deux spectres"
Q1)Quelle différence présente ces 2 spectres ?
Q2)A quoi correspondent les pics « inversés » du spectre de transmittance ?
3°)Allure dun spectre IR :
▪Dans
le bandeau supérieur cliquer sur l'outil ![]() . Utiliser à nouveau Charger un spectre IR et procéder comme avant pour sélectionner
IR_2-butanol.jdx.
. Utiliser à nouveau Charger un spectre IR et procéder comme avant pour sélectionner
IR_2-butanol.jdx.
Q3) Préciser quelle est la grandeur représentée en ordonnée ? Quelle est son unité ?
Q4)Choisir dans la liste suivante, en argumentant, lexpression de la transmittance T en fonction des
intensités lumineuses I et I0 :
T = I I0 |
T = I/I0 |
T = I0 I |
T = I0/I |
Q5)Quelle est lunité de la grandeur en abscisse ?
La grandeur associée est notée σ, appelée nombre donde . Elle est liée à la longueur donde λ.
Q6)Choisir dans la liste suivante la relation qui les unit : σ = λ ou σ = 1/ λ
Q7)Quelle est la particularité de laxe des abscisses ?
Q8)A laide de la relation choisie, montrer que les radiations utilisées correspondent à des radiations infrarouges.
4°)Bandes caractéristiques dabsorption :
Vous allez étudier différents spectres IR par comparaison et compléter le tableau suivant :
▪ Dans la barre doutils supérieure, sélectionner Spectroscopie IR/ Comparaison de spectres IR. Cocher la case nom de la molécule dans la fenêtre option.
Cliquer sur le dossier + (fenêtre du bas) et procéder comme avant pour ouvrir les spectres IR des molécules suivantes. Déplacer le curseur pour déterminer les valeurs de σ , leur intensité et leur taille:
Molécule |
Formule semi-développée |
Bande caractéristiques σ |
propanone « acétone » |
σ(C=O) = 1715 cm-1 ; fort ;fine |
|
propanal |
||
éthanoate de méthyle « méthyléthanoate » |
||
propan-1-ol |
||
acide propanoïque. |
Q9)Recopiez sur votre copie le tableau ci-dessus et complétez le (prévoir des cases de plus grande taille)
5°)Etude de spectres de 2 molécules proches :
|
‚ |
|
On donne les formules topologiques de 2 alcools : |
|
|
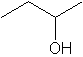
Q10) Associer un nom aux formules topologiques indiquées par et ‚ .
▪Dans la barre doutils supérieure, sélectionner Spectroscopie IR / Superposition des spectres IR. Dans cette nouvelle fenêtre, cliquer sur Charger le spectre darrière plan et choisir le composé dans la liste proposée, puis cliquer sur Spectre à superposer pour choisir le composé ‚ dans la liste.
Q11)Sans tenir compte des valeurs de T(%), identifier, sur laxe des abscisses, la zône des nombres donde où les spectres sont similaires et la zône où les spectres présentent plus de différences.
La zône des spectres IR due à lenchaînement carboné est appelée "empreinte digitale".
 |
Q12)Identifier sur le spectre la zone de lempreinte digitale et la zone due aux autres liaisons.
Q13)Choisir la bonne formulation :
Les formules topologiques des molécules et les spectres IR associés montrent que :
-les deux molécules ont/nont pas la même fonction et ont/nont pas la même chaîne carbonée
Q14)A l'aide de la table spectroscopique IR simplifiée (données), préciser sur le spectre en déplaçant le curseur quel pic correspond à la fonction caractéristique des alcools et celui correspondant aux liaisons C H :
σ ( ) = σ (C H) =
Q15)Rappeler pourquoi ces deux alcools sont de classes différentes . Quelles sont ces classes ?
6°)Cas particulier des liaison O-H :
▪ Ouvrir en les superposant les spectres du butan-1-ol gaz et du butan-1-ol solution.
Q16)
a) Quest-ce qui est à lorigine du O‑H lié ?
b) Quelle molécule contient la liaison O‑H libre ? O‑H lié ? Justifier.
c) Quelle en est la conséquence sur le spectre de lalcool ?
Q17)Le spectre du butan-2-ol présenté au 3°) a-t-il été obtenu en phase gazeuse ou en solution ? Argumenter.
7°)Identification dune molécule :
On doit identifier une espèce chimique qui peut-être lune des quatre molécules suivantes :
3-hydroxybutanone |
Ethanoate déthyle |
|
|
3-aminobutanone |
Pent-4-ène-2-ol |
|
|
Le document ci-après présente le spectre de lespèce inconnue :

Q18)A laide du spectre et du tableau de données, identifier cette molécule. Rédiger un court paragraphe mettant en évidence les étapes du raisonnement.
TABLEAU DE DONNEES :
Fonction |
liaison |
Nombre donde (cm-1) |
intensité |
alcane |
C‑H (C tétraédrique) |
28503000 |
Forte |
alcène |
C‑H (C trigonal) |
30103100 |
moyenne |
C=C |
16201680 |
variable |
|
alcool |
O‑H libre |
35003700 |
Forte ; fine |
O‑H lié |
32003600 |
F ; large |
|
aldéhyde |
C=O |
16501730 |
Forte |
C‑H (C trigonal) |
27502900 |
moyenne ; 2 pics |
|
cétone |
C=O |
16501730 |
Forte |
acide carboxylique |
C=O |
16801725 |
Forte |
O‑H |
25003300 |
F à m ; large |
|
C‑O |
12101320 |
Forte |
|
ester |
C=O |
17001740 |
Forte |
C‑O |
10001300 |
2 pics ou plus |
|
amine |
N‑H |
31003500 |
m |
N‑H |
15601640 |
F ou m |
|
amide |
N‑H |
31003500 |
F |
N‑H |
15601640 |
F ou m |
|
C=O |
16501700 |
TP TS - SPECTROSCOPIE INFRAROUGE - correction
1)Pour un spectre , c'est la transmittance en ordonnée , pour l'autre c'est l'absorbance .
2)Les pics inversés sur le spectre de transmittance correspondent aux zones pour lesquelles le rayonnement infrarouge est absorbé par la molécule .
3)C'est la transmittance qui est représentée en ordonnée . Cette grandeur est sans dimension (rapport de deux grandeurs de même nature) . Elle s'exprime en % .
4)T=I/I0
5)C'est le nombre d'onde s qui est en abscisse et celui-ci s'exprime en cm-1 .
6)s=1/l
7)L'axe des abscisses est orienté de droite à gauche (augmentation du nombre d'onde en lisant l'axe de droite à gauche).
8)*Pour s> 600 cm-1 , cela correspond à l< 1/600 = 1,6.10-3 cm = 1,6.10-5 m = 16000 nm
*Pour s<3800 cm-1 , cela correspond à l> 2,6.10-4 cm = 2,6.10-6 m = 2600 nm
Autrement dit 16000 nm > l >2600 nm. Cet intervalle est bien compris dans la zone infraroure [800 nm- 20.103 nm ]
9)
Molécule |
Formule semi-développée |
Bande caractéristiques σ |
propanone « acétone » |
|
σ(C=O) = 1715 cm-1 ; fort ;fine σ(C-H) = 3000 cm-1 ; moyenne, large σ(C-C) = 1220 cm-1 ;forte, fine |
propanal |
|
σ(C=O) = 1753 cm-1 ; fort ;fine σ(C-H)aldehyde = 2715 cm-1 ; moy , fine ; 2810 cm-1 (2 pics) σ(Ctet-H) = 3000 cm-1 ; forte, fine |
éthanoate de méthyle « méthyléthanoate » |
|
σ(Ctet-H) =2950 cm-1 ; forte, fine σ(C=0) = 1725 cm-1 ; forte, fine σ(C-O) = 1030 cm-1 ; moy, fine 1207 , 1160 cm-1 forte,fine (3 pics) |
propan-1-ol |
|
σ(O-H) = 3350 cm-1 ; forte, large 3640 (H lié ) σ(Ctet-H) = 2880 cm-1 ; forte, fine 2970 cm-1 |
acide propanoïque. |
|
σ(O-H) = 2990 cm-1 ; moy,large σ(C-O) = 1240 cm-1 ; moy, fine σ(C=O) = 1716 cm-1 ; forte,fine |
10) 1 : butan-2-ol
2: 2-méthylbutan-2-ol
11)On trouve des similitudes dans l'intervalle [2000 - 3600 cm-1]
On trouve des différences dans l'intervalle [600 - 1500 cm-1]
12)la zone [2000 - 3600 cm-1] est due aux liaisons , la zone [600 - 1500 cm-1] correspond à l'empreinte digitale de la molécule.
13)Les deux molécules ont la même fonction et n'ont pas la même chaîne carbonée
14) * alcools s (O-H) = 3350 cm-1 ; liaisons C-H : s(C-H) = 3000 cm -1
15)Pour le butan-2-ol : le carbone fonctionnel est porteur d'un atome d'hydrogène . Il s'agit d'un alcool secondaire .
Pour le 2-méthylbutan-2-ol le carbone fonctionnel n'est pas porteur d'atome d'hydrogène . Il s'agit d'un alcool tertiaire
16) a)Le O-H est lié s'il intervient dans une liaison hydrogène
b)La molécule H2O contient des O-H liés à l'état liquide ou solide . A l'état gazeux les molécules sont suffisamment éloignées pour qu'il puisse y avoir des liaisons hydrogène .
c)Sur le spectre apparaît une absorption importante à 3300 cm-1 lorsque O-H est lié .
d)Il est clair que dans 3°) le butan-2-ol est à l'état liquide (absorption importante à 3550 cm-1)
17)Il s'agit du pent-4-ène-2-ol.
Nous observons deux raies d'absorption importantes à 3350 cm-1 et à 2950cm-1 qui sont caractéristiques de la fonction alcool en phase liquide . L'absorption à 1600 cm-1 est caractéristique de la double liaison C=C.
Le spectre infrarouge de cette molécule est représenté ci-dessous :

Il est bien identique à celui proposé sur le polycopié .