TITRAGE DES IONS CHLORURE D'UNE EAU PAR METHODE CONDUCTIMETRIQUE
L'eau contient des espèces minérales dissoutes et notamment des ions chlorure Cl-(aq) . La législation française fixe à 200 mg/L la concentration massique maximale en ions chlorure d'une eau du robinet destinée à la consommation, excepté pour certaines eaux minérales pour lesquelles la concentration doit être indiquée sur l'étiquette.
I/Principe du titrage :
Les différents ions présents dans une eau entraînent sa conductance. Celle-ci est liée directement à la conductivité de la solution qu'un conductimètre permet d'obtenir facilement.
La conductivité dépend de la concentration des différents
ions présents et de la conductivité molaire ionique des ions considérés :![]()
![]() ou [Xi] représente les différents ions mono
chargés.
ou [Xi] représente les différents ions mono
chargés.
Nous nous intéressons aux ions chlorure que nous allons faire précipiter avec des ions argent Ag+ en introduisant dans le milieu réactionnel une solution de nitrate d'argent: Ag+ + NO3-.
La quantité des autres ions présents ne variant pas, on
écrira la conductivité de la solution avant l'introduction du nitrate d'argent
sous la forme : ![]() où a est une
constante caractérisant l'action des autres ions présents. Pendant la réaction
de précipitation, avant qu’on ait atteint l'équivalence, la conductivité
devient: .
où a est une
constante caractérisant l'action des autres ions présents. Pendant la réaction
de précipitation, avant qu’on ait atteint l'équivalence, la conductivité
devient: . ![]() , [Cl-]1 et [NO3-]1 sont les concentrations au moment
du calcul.
, [Cl-]1 et [NO3-]1 sont les concentrations au moment
du calcul.
On donne les conductivités molaires ioniques suivantes en S.m2.mol-1 : l(Ag+) = 61,9.10-4 S.m2.mol-1 ; l(NO3-) = 71,4.10-4 S.m2.mol-1 ; l(Cl-)=76,3.10-4 S.m2.mol-1
Q1/Ecrire l'équation de la réaction de précipitation.
Q2/Quelle relation lie à l'équivalence, la quantité initiale d'ions chlorure et la quantité d'ions argent introduite ?
Q3/Pourquoi, dans s1, ne tient-on pas compte des ions Ag+ introduits ?
Q4/Ecrire l'expression de la conductivité s2 de la solution lorsque l'équivalence est dépassée.
On utilise un volume d'eau noté V0 , dont la concentration en ions chlorure est C0 . On y verse progressivement une solution de nitrate d'argent de concentration C1.
Q5/Etablir le tableau d'avancement de la réaction en indiquant l'état où un volume V1 de nitrate d'argent a été introduit.
Q6/ Quelles sont à ce moment les concentrations dans la solution des ions Ag+,Cl- et NO3- ?. On distinguera 3 cas :
a) avant que l 'équivalence soit atteinte
b) à l 'équivalence
c) après l'équivalence
Tenant compte des diverses expressions de s , et en admettant que le volume V1 de solution de nitrate d'argent introduit est petit devant V0 (ce qui revient à assimiler le terme V0+V1 à V0) ,nous obtenons :
a-avant l'équivalence :![]()
Avec V0 >> V1 , cela donne :
b-à l'équivalence :![]() , ce qui avec V0>>V1 , donne :
, ce qui avec V0>>V1 , donne : ![]()
c-après l'équivalence :![]() . Avec V0>>V1 , nous obtenons
finalement : :
. Avec V0>>V1 , nous obtenons
finalement : :![]()
En remplaçant par les valeurs numériques , les expressions ci-dessus deviennent :
Avant l’équivalence :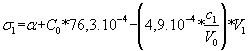
Il s'agit d'une fonction affine :
* d'ordonnée à l'origine a + 76,3 . 10-4 * C0
* de coefficient directeur négatif : - 4,9 . 10-4 * C1/V0
A l’équivalence ![]()
Après l’équivalence :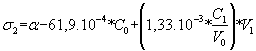
Il s'agit d'une fonction affine :
* d'ordonnée à l'origine a - 61,9 . 10-4 * C0
* de coefficient directeur positif : 1,33 . 10-2 * C1/V0
La représentation graphique correspondante doit donc être du type :
Expérimentalement, il est possible de mesurer s en fonction de V1. La représentation graphique permet
d’obtenir la valeur V1 pour laquelle l'équivalence est atteinte, donc de connaître la concentration initiale en ions chlorure.
II/Manipulation :
l) Dosage des ions chlorure de l'eau du robinet
On mesure avec une éprouvette graduée 200 mL d'eau du robinet qu'on place dans un grand
bêcher. On remplit la burette d'une solution de nitrate d'argent de concentration C1 = 10-2 mol.L-1.
Après étalonnage du conductimètre, on relève la conductivité de la solution après chaque ajout d'un mL de solution de nitrate d'argent. On versera au total 20 mL de nitrate d'argent.
Q7/Placer les résultats dans un tableau de mesures. Ne pas oublier de relever la conductivité correspondant au volume V1 = 0 mL.
Q8/Faire la représentation graphique s =f(V1), en déduire le volume d'équivalence V1 de la réaction de titrage.
Q9/ Calculer la concentration en ions chlorure de l'eau du robinet. Conclure.
2) Vérification de la concentration en ions chlorure d'une eau minérale.
On veut vérifier la concentration en ions chlorure de l'eau de Vichy. Celle-ci étant très concentrée,
pour pouvoir faire la même approximation sur le calcul que précédemment, on dilue l'eau 10 fois avec de l 'eau distillée, exempte d'ions chlorure.
Q10/Indiquer le protocole a suivre pour préparer 100 mL d'eau de Vichy diluée 10 fois.
On place ces 100 mL dans un bêcher et on fait les mesures de conductivité comme précédemment , en ajoutant mL par mL, 15 mL de solution de nitrate d'argent.
Q11/Placer les résultats dans un tableau.
Q12/Tracer la représentation graphique s=f(V1).
Q13/A partir du volume équivalent, calculer la concentration en ions chlorure de l'eau de Vichy diluée et celle de l'eau non diluée. Comparer à l'étiquette.
Titrage des ions chlorure d'une eau par méthode conductimètrique : correction
1)On obtient un précipité de chlorure d'argent : Ag++Cl- ------> AgClsolide . Cette réaction est totale .
2)D'après l'équation de la réaction ci-dessus , à l'équivalence , nous avons : n(Cl- introduit ) = n(Ag+ versés)
3)s1 est la conductivité de la solution avant l'équivalence et tant que l'équivalence n'est pas atteinte , les ions Ag+ versés réagissent avec les ions Cl- et ne sont donc pas présents comme ions "mobiles" dans la solution : c'est la raison pour laquelle on ne tient pas compte des ions Ag+ dans s1 .
4)s2 = a + lAg+[Ag+] + lNO3-[NO3-] (il n'y a plus d'ions Cl- dans la solution ) .
5)
Avancement |
Ag+ + Cl- ----------> AgCl |
NO3- |
||||
Etat initial |
X=0 |
C1V1 |
C0V0 |
0 |
||
Etat final |
X |
C1V1 - Xf |
C0V0 - Xf |
solide |
C1V1 |
|
avant l'équivalence : C1V1 - Xf = 0 mol ou Xf =C1V1 (Ag+ réactif limitant)
après l'équivalence : C0V0 - Xf = 0 mol ou Xf= C0V0 (Cl- réactif limitant)
à l'équivlence : C0V0 - Xf = C1V1 - Xf = 0 mol ou C0V0 = C1V1 .
6) En exploitant le tableau d'avancement précédent , nous obtenons :
a) avant l'équivalence :
[Ag+ ] = 0 mol.L-1 ; [Cl-] =(C0V0 - C1V1 )/(V0+V1) : [NO3-] = C1V1 /(V0+V1)
b)A l'équivalence :
[Ag+]=[Cl-] = 0 mol.L-1 ; [NO3-] = C1V1 /(V0+V1) = C0V0 /(V0+V1)
c)Après l'équivalence :
[Cl- ] = 0 mol.L-1 ; [Ag+] =(C1V1 - C0V0 )/(V0+V1) : [NO3-] = C1V1 /(V0+V1)
7)
V1(mL) |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
s (mS.cm-1) |
0,29 |
0,288 |
0,287 |
0,286 |
0,284 |
0,283 |
0,281 |
0,28 |
0,278 |
0,277 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
0,275 |
0,275 |
0,279 |
0,284 |
0,29 |
0,294 |
0,299 |
0,305 |
0,310 |
0,314 |
0,319 |
8)
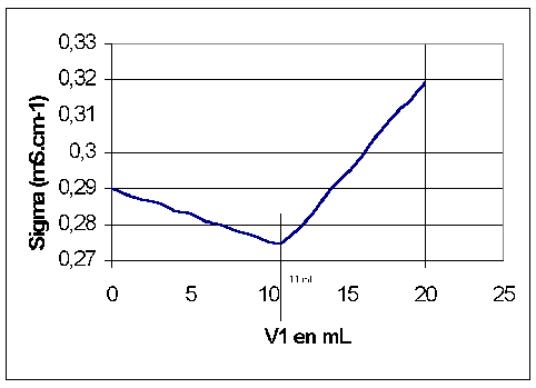
Le volume V1,equiv est obtenu en déterminant l'abscisse du point d'intersection des deux droites :
V1,equiv = 11 mL
9/ A l'équivalence C0V0 = C1V1,equiv (voir Q5) et donc C0 = C1V1,equiv / V0 = 5,5 . 10-4 mol.L-1 .
La concentration massique correspondante est donc C0* 35,5 = 0,0195 g.L-1 = 19,5 mg.L-1 . Cette valeur est inférieure à la limite fixée par la législation française (<< 200 mg.L-1).
10/Il s'agit de diluer 10 fois l'eau de Vichy .
On prélève donc avec une pipette jaugée de 10 mL , 10 mL d'eau de Vichy que l'on verse dans une fiole jaugée de 100 mL . On complète avec de l'eau distillée jusqu'au trait de jauge en prenant soin de bien agiter .
11/
V1(mL) |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
s (mS.cm-1) |
0,810 |
0,804 |
0,797 |
0,787 |
0,782 |
0,775 |
0,769 |
0,761 |
0,754 |
0,747 |
10 |
11 |
12 |
13 |
14 |
15 |
0,275 |
0,756 |
0,761 |
0,7 |
0,769 |
0,773 |
12/
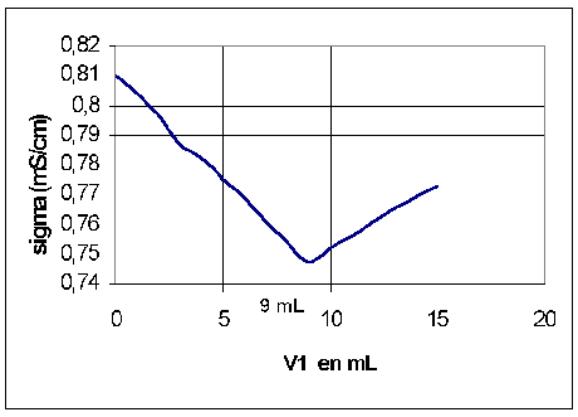
V1,equiv = 9 mL
13/ C' = 9 . 10-4 mol.L-1 . La concentration de l'eau de Vichy St Yorre est donc C0 = 9 .10-3 mol.L-1 . La concentration massique est par conséquent : 9*35,5 . 10-3 = 0,320 g/L = 320 mg.L-1 .
Sur l'étiquette , on lit "ions chlorures" : 322 mg.L-1 , ce qui à 2/320*100=0,7 % près correspond à la valeur expérimentale mesurée .