TP TS - CINETIQUE DE LA REACTION ENTRE L'EAU OXYGENEE
ET LES IONS IODURE - spectrophotomètre
I/La réaction étudiée:
La réaction étudiée est celle de l'eau oxygénée avec l'es ions iodures :
![]()
Le spectrophotomètre va permettre de suivre la concentration du diiode I2 en fonction du temps . La solution initialement incolore devient jaune puis brune à cause de la formation de I2 .
II/ Présentation des différents mélanges:
Les réactifs sont mélangés dans des proportions différentes . C'est ce que traduit le tableau ci-dessous :
Acide sulfurique 1,0 mol.L-1 |
Iodure de potassium 0,10 mol.L-1 |
H2O2 0,1 mol.L-1 |
eau distillée |
|
solution 1 |
10 mL |
18 mL |
2 mL |
0 mL |
solution 2 |
10 mL |
10 mL |
2 mL |
8 mL |
solution 3 |
10 mL |
10 mL |
1 mL |
9 mL |
solution 4 |
5 mL |
18 mL |
2 mL |
5 mL |
Q1)Calculer les quantités de matière d'ions iodure I- et d'eau oxygénée introduites dans chacune de ces solutions .Calculez les concentrations correspondantes . Complétez le tableau 1 .
Q2)Quelles sont les concentrations en diiode I2 attendues pour chaque solution (réaction totale) au bout d'un temps infini ? Complétez le tableau 2
III/L'étalonnage du spectrophotomètre
a)Principe
Les solutions utilsées contiennent toutes de l'iodure de potassium KI , de l'acide sulfurique H2SO4 et de l'eau . Ces composants vont avoir une action sur le faisceau lumineux qui va traverser la cuve qui contient l'une des solutions et qui est introduite dans le spectrophotomètre.
Or nous voulons ne prendre en compte que l'absorption du faisceau due au diiode I2 afin de pouvoir suivre l'évolution de la réaction entre l'eau oxygénée et les ions iodure I- .
Soit S1 une solution constituée de 15 mL de solution de KI , de 15 mL d'acide sulfurique et de 20 mL d'eau distillée .
Soit S2 une solution constituée de KI , d'acide sulfurique , d'eau distillée et de diiode I2 .
Nous pouvons écrire :
Absorption due à I2 = Absorption due à S2 - Absorption due à S1
Le spectrophotomètre effectue automatiquement cette opération , à condition qu'on ait procédé au préalable au réglage du zéro . Ce réglage est réalisé en mesurant l'absorption due à S1 .
Le réglage du zéro ayant été réalisé , on effectue différentes mesures de l'absorption pour des solutions S2 dont les concentrations en diiode sont connues .
ces différentes mesures permettent de tracer la courbe d'étalonnage du spectrophotomètre : [I2] = fonction de A(I2)
b)Utilisation de la loi de Beer
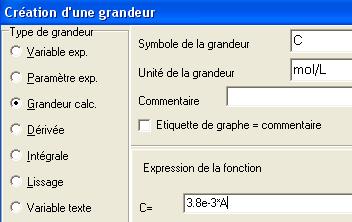
A = k * C , C étant la concentration en diiode
Un étalonnage préalable a permis de déterminer k =263 L.mol-1 . Nous en déduisons :
C= 1/263 * A = 3,8.10-3 * A avec C en mol.L-1
IV/ Suivi de la réaction : tracé des courbes
a)Protocole
Le mélange des solutions de KI et d'eau oxygénée ayant été réalisé (instant t=0 ) dans les proportions correspondant par exemple à la solution 1 , la cuve contenant la solution est immédiatement introduite dans le spectrophotomètre .
Celui-ci effectue une acquisition à chaque seconde sur une durée de 1600 secondes
La même opération est effectuée pour les quatre solutions , ce qui au total fait 6400 couples de mesures (tj , Aj ) . Ces acquisitions permettent de tracer pour chaque solution la courbe d'absortion due à I2 en fonction du temps .
Il est clair que la courbe d'étalonnage du spectrophotomètre permet d'en déduire , pour chaque solution [I2]= f(t) .
c)Tracé des courbes A1(t) , A2(t) , A3(t) et A4(t)
Les acquisitions ont été effectuées hors TP . Celles-ci ont été traitées et rassemblées dans le fichier lisible par Regressi : une page par série .
Lancer Regressi à partir du dossier MICRELEC (double click sur l'icône Regressi)
Fichier/ouvrir/cinet2013/ok
Activer si
nécessaire la fençtre graphique ![]() pour visualiser les courbes .
pour visualiser les courbes .
d)Tracé des courbes [I2]1(t) ,[I2]2(t), [I2]3(t), [I2]4(t)
A partir de la
fenêtre "grandeurs" ![]() , créer une grandeur
, créer une grandeur ![]()
 Ok
Ok
-Sélectionnet la
fenêtre "graphe" , modifier les coordonnées ![]() (t en abscisse , C en ordonnée )
(t en abscisse , C en ordonnée )
- cocher la case "superposition des pages" - Ok
Les quatres courbes doivent apparaître à l'écran .
d)Impression
-Fichier/param.Imprimante/
Cocher paysage puis Ok
-Fichier/Imprimer
Une fenêtre s'ouvre . Sélectionner uniquement les cases
*graphe
*en-tête
Inscrivez votre nom dans le bas de la fenêtre puis click Imprimer
-Récupérez le document à l'imprimante(une feuille par élève)
Q3)Identifier les courbes par leur numéro de pagequi est aussi le numéro de chacune des solutions .
e)Limites :
Q4)Les limites obtenues correspondent-elles aux valeurs attendues ? Les réactions sont-elles totales ?(utliser les résultats théoriques du tableau 2)
V/Exploitation des mesures - Facteurs cinétiques
a)Facteurs cinétiques
Les grandeurs qui agissent sur la vitesse d'évolution d'un système chimique sont appelés facteurs cinétiques .
Parmi les facteurs cinétiques citons :
* la température
* la concentration des réactifs
* les catalyseurs
b)Influence de la concentration des réactifs et du catalyseur
L'acide sulfurique est ici un catalyseur de la réaction
Q5 )Les paramètres considérés étant ici [I-] , [H2O2] et [H3O+] , quel est le paramètre qui à l'instant t = 0 s différencie :
* la solution 1 de la solution 2 ?
*la solution 2 de la solution 3 ?
*la solution 1 de la solution 4 ?
c)Influence de la température
Une augmentation de la température du milieu réactionnel se traduit généralement par une augmentation de la vitesse de formation d'un corps .
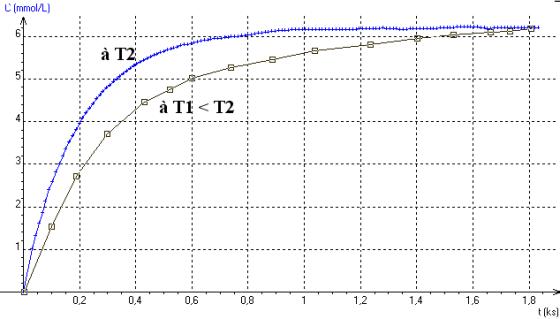
Q6)Représentez sur votre copie [I2](t) pour la solution 1 . Sur le même graphique , représentez l'allure qu'aurait [I2](t) si la réaction avait lieu à une température plus basse .
VI/Temps de demi-réaction
On appelle temps de demi-réaction t1/2 la durée nécessaire pour consommer la moitié du réactif limitant ( ou réactif en défaut) initialement présent .
Q7)Quel est le réactif limitant pour les solutions utilisées .
Q8)Déterminer le temps de demi-réaction pour chacune des solutions ?Celui-ci est-il compatible avecles données initiales . Expliquez
VII/Vitesse de formation du diiode au cours de la réaction
On peut assimiler la vitesee de formation du diiode à un instant au coefficient directeur de la tangente à la courbe à cet instant .
Q9)Comment évolue cette vitesse au cours du temps pour chacune des courbes ? Justifiez .Quel facteur cinétique permet de justifier cette évolution ?
Q10)Que peut-on dire de la vitesse de formation du diiode au bout d'un temps infini ?
Tableau 1
Solution J |
solution 1 |
solution 2 |
solution 3 |
solution 4 |
n0(I-) en mol |
||||
[I-]0 en mol.L-1 |
||||
n0(H2O2) en mol |
||||
[H2O2]0 en mol.L-1 |
Tableau 2
Solution J |
solution 1 |
solution 2 |
solution 3 |
solution 4 |
|
||||
|
TP . cinétique de la réaction entre l'eau oxygénée et les ions iodures - correction
1) n0(I-)= CKI* VI- ; n0(H2O2) = CH2O2 * VH2O2 [I-]0= n0(I-)/Vsolution où Vsolution est le même pour chacune des solutions : 30 mL . Les résultats (en faisant attention aux unités sont rassemblés dans le tableau :
Solution J |
solution 1 |
solution 2 |
solution 3 |
solution 4 |
n0(I-) en mol |
1,8.10-3 |
1.10-3 |
1.10-3 |
1,8.10-3 |
[I-]0 en mol.L-1 |
6.10-2 |
3,3.10-2 |
3,3.10-2 |
6.10-2 |
n0(H2O2) en mol |
2.10-4 |
2.10-4 |
1.10-4 |
2.10-4 |
[H2O2]0 en mol.L-1 |
6,6.10-3 |
6,6.10-3 |
3,3.10-3 |
6,6.10-3 |
2)Avant de répondre à la question posée il est nécesaire de déterminer le réactif limitant. Il est clair que pour chacune des solutions , nous avons bien : nH2O2,introduit/1 < nI-,intoduit/2 , ce qui signifie que pour chacune des solutions c'est H2O2 qui est le réaxtif limitnat.
Comme une mole de H2O2 contribue à la formation d'une mole de I2 d'après l'équation de la réaction , Le nombre de moles de I2 attendues est égal au nombre de moles de H2O2 introduites , d'où le tableau :
Solution J |
solution 1 |
solution 2 |
solution 3 |
solution 4 |
|
2.10-4 |
2.10-4 |
1.10-4 |
2.10-4 |
|
6,6.10-3 |
6,6.10-3 |
3,3.10-3 |
6,6.10-3 |
3)
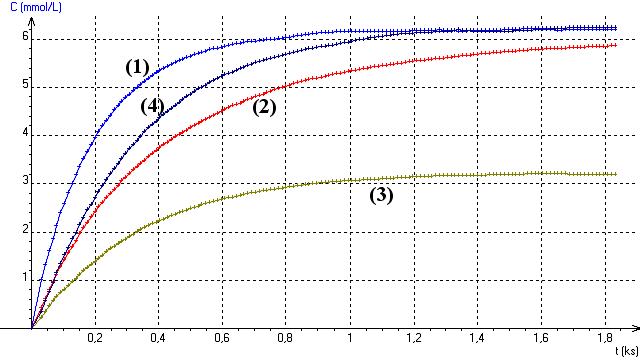
Pour identifier les courbes on peut utiliser les couleurs pour chacune des pages ou repérer des valeurs numériques.
4)Les limites obtenues correspondent effectivement aux valeurs attendues:
courbe 1 (ou solution 1) [I2]oo = 6,5.10-3 mol/L
courbe 2 (ou solution 2) [I2]oo = 6,5.10-3 mol/L : pour cette courbe la réaction n'était pas encore terminée lorsque l'acquisitio a été arrêtée . Une acquisition un peu plus longue aurait permis de constater que les courbes (1) et (2) étaient confondues à la fin de l'acquisition.
courbe 3 (ou solution 3) [I2]oo = 3,3.10-3 mol/L
courbe 4 (ou solution 4) [I2]oo = 6,5.10-3 mol/L
5)
*Les solutions (1) et (2) ne différent que par la concentration en ions iodures : [I-]0,solution 1 > [I-]0,solution 2
*Les solutions (2) et (3) ne différent que par la concentration en eau oxygénée : [H2O2]0,solution 2 > [H2O2]0,solution 3
*Les solutions (1) et (4) ne différent que par la concentration en acide sulfurique qui ici est un catalyseur de la réaction [H3O+]solution4 < [H3O+]solution1
6)A une température plus basse la réaction est plus lente et la limite est par conséquent atteinte moins rapidement :
7)Comme cela a été écrit plus haut , dans toutes les solutions H2O2 est le réactif limitant
8)Si à l'état final [I2] est constant et égal à [I2]final (réactio terminée), alors , le temps de demi-réaction t 1/2 est l'abscisse du point de la courbe de [I2](t) tel que [I2](t1/2) = [I2]final /2.
Cela donne , en utilisant les différentes courbes ;
solution 1 : t1/2 = 150 s
solution 2 : t1/2 = 300 s
solution 3 : t1/2 = 300 s
solution 4 : t1/2 = 260 s
9)Pour toutes les courbes le coefficient directeur de la tangente diminue , autrement dit , la vitesse de formation de I2 diminue . Au cours de la réaction les réactifs réagissent et par conséquent leur concentration diminue . C'est donc le facteur "concentration des réactifs" qui est reponsable de cette évolution .
10)La vitesse de formation de I2 est nulle lorsque la réaction est terminée (tangente horizontale , donc de coeffficient directeur nul).