TP – Titrage par étalonnage - Spectrophotomètre
I/But du TP
- realiser un spectre de solution colorée
- Etalonner le spectrophotomètre
- Déterminer la concentration d'une solution
II/ - Spectre d'absorption
a)Définition de l'absorbance
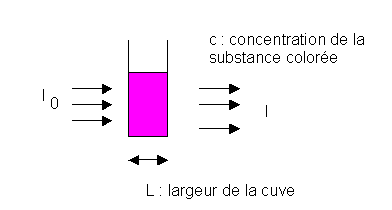
L : largeur de la cuve 1 cm
I0 : intensité de la lumière monochromatique incidente
I : intensité de la lumière transmise
![]() A est
l'absorbance de la solution
A est
l'absorbance de la solution
(ln est la fonction
logarithme népérien , fonction réciproque de la fonction exponentielle : y= ln
x ![]() x = ey)
x = ey)
On utilise une solution très diluée de permanganate de potassium
Q1) Représenter le spectre A = f(l) et indiquer la valeur de A au pic d'absorption maximale
III/Etalonnage du spectrophotomètre :
a)Réalisation de solutions de diiode de concentrations connues
S1 : sol I2 à 2 10-2 mol.L-1
S2 : sol KI (K++ I-) à 0,1 mol/L
S3 : sol acide sulfurique H2SO4 à 1 mol/L
L'étalonnnage est réalisé en utilisant des solutions de diiode I2 de concentration connue . Il s'effectue à la longueur d'onde l= 490 nm .
N° |
V de I2(mL) |
V de KI (mL) |
V acide (mL) |
eau distillée |
[I2] mmol/L |
A |
0 |
0 |
15 |
15 |
20 |
||
1 |
5 |
15 |
15 |
15 |
||
2 |
8 |
15 |
15 |
12 |
||
3 |
10 |
15 |
15 |
10 |
||
4 |
12 |
15 |
15 |
8 |
||
5 |
15 |
15 |
15 |
5 |
||
6 |
20 |
15 |
15 |
0 |
Q2)Reproduisez le tableau sur votre copie et complétez la colonne " [I2] "
b)Absorbance des solutions précédentes :
On règle le spectrophotomètre sur la longueur d'onde l= 490 nm .
Q3)Complétez le tableau en inscrivant les différentes mesures de l'absorbance A effectuées avec le spectrophotomètre .
Q4)Représentez sur votre copie A=f([I2]). En déduire que f est une fonction linéaire dont on déterminera le coefficient directeur k , tel que A=k.[I2]
On pourra utiliser le logiciel de traitement de données Regressi
c)Loi de Beer-Lambert
Le résultat que nous venons d'établir expérimentalement est en fait une vérification partielle de la loi de Beer-Lambert :
A = e(l)*L*c où
e(l) dépend de la substance utilisée . Appelée absorbance molaire , pour une longueur d'onde donnée , c'est une constante .
Q5)Quelle est la valeur de e(l) dans l'étalonnage réalisé ?
IV/détermination de la concentration d'une solution de diiode :
On introduit une solution de diiode dans le spectrophotomètre et on mesure son absorbance :
A = ……
Q6)Quelle est la concentration en diiode de cette solution ?
V/Exercices :
7 page 455 , 28 page 461
Correction TP – Titrage par étalonnage - Spectrophotomètre
1)A = f(l) - permanganate de potassium KMnO4
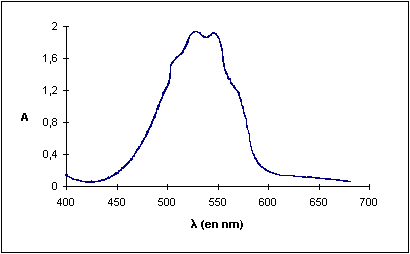
Pour l=530 nm , l'absorbance est maximale et égale à Amax=2
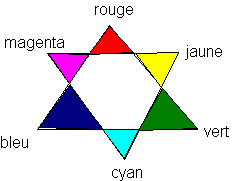
C'est dans la couleur verte que l'absorbance est maximale . Ce n'est pas surprenant que la solution de permanganate de potassium ait une couleur magenta qui est la couleur complémentaire du vert .
2)[I2] est la concentration en diiode dans le mélange
[I2] = (cI2*VI2)/Vsolution avec Vsolution= 50 mL
N° |
V de I2(mL) |
V de KI (mL) |
V acide (mL) |
eau distillée |
[I2] mmol/L |
A |
0 |
0 |
15 |
15 |
20 |
0 |
0 |
1 |
5 |
15 |
15 |
15 |
2 |
0,6 |
2 |
8 |
15 |
15 |
12 |
3,2 |
0,9 |
3 |
10 |
15 |
15 |
10 |
4 |
1,1 |
4 |
12 |
15 |
15 |
8 |
4,8 |
1,3 |
5 |
15 |
15 |
15 |
5 |
6 |
1,7 |
6 |
20 |
15 |
15 |
0 |
8 |
2,2 |
3)Absorbance A : elle est mesurée avec le spectrophotomètre.
Voir tableau ci-dessus
4)A en fonction de [I2]

Soit un point M sur la courbe dont les coordonnées sont [I2]M= 6 mmol.L-1 et AM=1,7 , le coefficient directeur k de la fonction linéaire est donné k= AM/[I2]M = 1,7/6= 0,28 L.mmol-1 .
5)Comme la largeur de la cuve est égale à 1 cm et que k = e(l)*L= 0,28 L.mmol-1 , nous en déduisons e(l) = k/L=0,28/1 = 0,28 L.mmol-1cm-1 = 0,28.(10-3*10-2)-1= 28.103 L.mol-1.m-1
6)On introduit la cuve contenant la solution de concentration inconnue dans le spectrophotomètre . La mesure de l'absorbance donne A=1 . En utilisant la courbe , nous en déduisons que C=3,5 mmol.L-1 .
Exercice 7 page 455 :
a. Par lecture graphique, on trouve c1 = 3,6 mmol.L-1
b. Par lecture graphique, on trouve A'400 = 0,72.
Exercice 28 page 461 :
1/Mélange initial : nD= C0V0 = 2 . 10-2*20.10-3= 4,0.10-4 mol
2/Réaction entre le glucose et le diiode :
a)Couples oxydant/réducteur : RCO2- (aq)/RCHO (aq) et I2 (aq)/I - (aq)
Les oxydants sont l’ion gluconate RCO2- et le diiode I2.
Les réducteurs sont le glucose RCHO et l’ion iodure I -.
b. La solution étant colorée, il reste donc du diiode dans le milieu réactionnel. Le réactif limitant est le glucose
c.
I2 + RCHO + 3 HO- -----> 2I- + RCO2- + 2H2O |
||||||
E I |
nD |
nG |
excès |
0 |
0 |
solvant |
en cours |
nD-x |
nG-x |
excès |
2x |
x |
solvant |
E final |
nR |
nG-xmax |
excès |
2xmax |
xmax |
solvant |
d.le réactif limitant étant le glucose : nG-xmax= 0 . Comme nR=nD-xmax , nous en déduisons nG=nD-nR
3/Dosage du diiode en excès :
a.Par lecture graphique nous en déduisons la concentration cR de diiode restant dans la solution : cR= 3 mmol.L-1 , d'où nR= cR*Vfiole =3.10-3*50.10-3 = 1,5.10-4 mol
b.nG=nD-nR = 4.10-4 - 1,5.10-4 = 2,5.10-4 mol .
4/Conclusion :
nG représent la quantité de glucose présent dans 2 mL de jus de fruit , d'où n'G=500*nG=0,13 mol.et par conséquent : mG=n'G*M = 500*2,5.10-4*180 = 23 g