TP : Suivi cinétique d'une réaction chimique par conductimétrie
I/But du TP
Suivre l'évolution dans le temps de l'hydrolyse du 2-chloro-2-méthylpropane et calculer la vitesse de réaction à différentes dates.
II/Manipulation
Afin de favoriser les contacts entre les réactifs, le 2-chloro-2-méthylpropane a été auparavant dissous dans de l'acétone ( propanone ). Dans une fiole jaugée 100 mL, on a versé 4 mL de 2-chloro-2-méthylpropane et on a complété avec de l'acétone jusqu'au trait de jauge. On a alors obtenu une solution notée S1.
Dans un bêcher de 250 mL , on place 200 mL d'eau distillée ainsi que la cellule d'un conductimètre.
A la date t = 0 s, on déclenche un chronomètre en versant 5 mL de la solution S1. Un turbulent, et son agitateur magnétique, permet d'homogénéiser la solution obtenue.
La sensibilité du conductimètre sera ajustée à 20 mS.cm-1
On relève alors, sans arrêter le chronomètre, la conductivité de la solution d'abord toutes les 5 secondes , puis toutes les 10 secondes et ainsi de suite comme indiqué dans le tableau ci-dessous où on place les différentes conductivités.
III/Mesures et exploitation des résultats :
Q1)Rassembler les résultats dans un tableau du type de celui-ci-dessous :
Date (s ou mn) |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
40 |
50 |
60 s ou 1 min |
1 mn 15 |
…… |
11 mn |
s (ms.cm-1) |
|||||||||||||
x (mol) |
Q2)Ecrire les formules semi développées du 2-chloro-2-méthylpropane et de la propanone.
2)Formules :
2-chloro-2-méthylpropane Propanone :

L'action de l'eau sur le 2-chloro-2-méthylpropane produit un alcool dont la formule semi développée s'écrit (CH3)3C-OH , des ions oxonium H3O+ et des ions chlorure.
Q3)Ecrire l'équation de la réaction. Quel est le nom de l'alcool formé ? Quelle est sa classe ?
3)CH3-CCH3Cl-CH3 + 2H2O -------> (CH3)3-C-OH + Cl- + H3O+
L'alcool formé est le 2,2-diméthyléthanol.
C'est un alcool tertiaire
Q4)Calculer la concentration en 2-chloro-2-méthylpropane de la solution S1. En déduire la quantité de 2-chloro-2- méthylpropane introduite dans le bêcher.
La masse molaire du 2-chloro-2-méthylpropane est M = 92,0 g/mol et sa masse volumique vaut 0,85g/cm3.
4)La masse de 2-chloro-2-méthylpropane introduite pour 100 mL de solution est m=r*V = 0,85*4= 3,4 g , ce qui correspond à la quantité de matière n= m/M =3,4/92 = 3,7.10-2 mol .
Q5)Etablir le tableau d'avancement de la réaction. Exprimer à la date t la relation entre l'avancement x et les concentrations [H3O+] et [Cl-]
5)
CH3-CCH3Cl-CH3 + 2H2O -------> (CH3)3-C-OH + Cl- + H3O+ |
|||||
EI |
0,037 mol |
excès |
|||
0,037 - X |
excès |
X |
X |
X |
|
Q6)Exprimer la conductivité s du mélange en fonction de la concentration [H3O+] et des conductivités molaires ioniques lH3O+= 349,8.10-4 S.m2.mo1-1 et lCl-= 76,3.10-4 S.m2.mo1-1.
6)D'après le tableau d'avancement [H3O+]= [Cl-]= X/Vsolution
![]() , la sommation étant effectuée sur les espèces ioniques .
, la sommation étant effectuée sur les espèces ioniques .
s = lH3O+ [H3O+] + lCl-[Cl-] = (lH3O+ + lCl-) [H3O+] = 426,1.10-4 * [H3O+]
Q7)Exprimer alors cette conductivité en fonction de l'avancement x de la réaction, du volume V du mélange réactionnel et des conductivités molaires ioniques.
7)s = 426,1.10-4 * X/V avec V=Vsolution
Q8)Compléter le tableau des résultats en calculant l'avancement x à chaque date. (Attention, exprimer la conductivité en S.m-1 pour être en cohérence avec l'unité dés conductivités molaires ioniques).
Q9)Représenter graphiquement l'avancement en fonction du temps.
La vitesse de la réaction à un instant t est égale à vitesse = (1/V)*(dx/dt) . Celle-ci est donc proportionnelle au coefficient directeur de la tangente à la courbe précédemment tracée à l'instant t considéré .
vitesse(t) = (1/V)* coefficient directeur de la tangente à l'instant t
Q10)calculer la vitesse de réaction aux dates t1 = 1 min et t2 = 6 min .Comparer ces deux vitesses et en déduire comment celle-ci évolue au cours du temps .
Q11)Quel facteur cinétique permet d'expliquer la variation de la vitesse au cours de la réaction?Détaillez votre réponse.
Q12)A partir du tableau d'avancement, calculer l'avancement maximal On l'exprimera en mol.
Q13)Utiliser la représentation graphique précédente pour déterminer la valeur expérimentale de l'avancement maximal. Ces deux valeurs concordent-elles ?
Q14)Définir le temps de demi réaction t1/2 et estimer graphiquement sa valeur.
Correction du TP :
TP : Suivi cinétique d'une réaction chimique par conductimétrie - Correction
1) Mesures
Date (s) |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
40 |
50 |
s (mS/cm) |
0,00 |
0,16 |
0,32 |
0,47 |
0,62 |
0,75 |
0,89 |
1,14 |
1,36 |
s (S/m) |
0,000 |
0,016 |
0,032 |
0,047 |
0,062 |
0,075 |
0,089 |
0,114 |
0,136 |
X (mol) |
0,00E+00 |
7,70E-05 |
1,51E-04 |
2,22E-04 |
2,89E-04 |
3,54E-04 |
4,16E-04 |
5,33E-04 |
6,40E-04 |
Date (s) |
60 |
75 |
80 |
95 |
110 |
120 |
180 |
s (mS/cm) |
1,57 |
1,85 |
1,94 |
2,18 |
2,39 |
2,51 |
3,07 |
s (S/m) |
0,157 |
0,185 |
0,194 |
0,218 |
0,239 |
0,251 |
0,307 |
X (mol) |
7,38E-04 |
8,70E-04 |
9,11E-04 |
1,02E-03 |
1,12E-03 |
1,18E-03 |
1,44E-03 |
Date (s) |
240 |
300 |
360 |
420 |
480 |
540 |
600 |
s (mS/cm) |
3,40 |
3,60 |
3,72 |
3,79 |
3,84 |
3,86 |
3,88 |
s (S/m) |
0,340 |
0,360 |
0,372 |
0,379 |
0,384 |
0,386 |
0,388 |
X (mol) |
1,60E-03 |
1,69E-03 |
1,75E-03 |
1,78E-03 |
1,80E-03 |
1,81E-03 |
1,82E-03 |
2)Formules :

3)CH3-CCH3Cl-CH3 + 2H2O -------> (CH3)3-C-OH + Cl- + H3O+
L'alcool formé est le 1,1-diméthyléthanol (ou diméthyéthanol).
C'est un alcool tertiaire
4)La masse de 2-chloro-2-méthylpropane introduite pour 100 mL de solution est m=r*V = 0,85*4= 3,4 g , ce qui correspond à la quantité de matière n= m/M =3,4/92 = 3,7.10-2 mol . Dans le bécher ont été introduits 5 mL sur les 100 mL de la solution S1 , soit 1/20 de la solution S1 Autrement dit , la quantité de 2-chloro-2-méthylpropane introduite dans le bécher est égale à n0 = n/20 = 1,85.10-3 mol.
5)
CH3-CCH3Cl-CH3 + 2H2O -------> (CH3)3-C-OH + Cl- + H3O+ |
|||||
EI |
1,85.10-3 mol |
excès |
|||
E intermédiaire |
1,85.10-3 - X |
excès |
X |
X |
X |
6)D'après le tableau d'avancement [H3O+]= [Cl-]= X/Vsolution
![]() , la sommation étant effectuée sur les espèces ioniques .
, la sommation étant effectuée sur les espèces ioniques .
s = lH3O+ [H3O+] + lCl-[Cl-] = (lH3O+ + lCl-) [H3O+] = 426,1.10-4 * [H3O+]
7)s = 426,1.10-4 * X/V avec V=Vsolution , ce qui donne pour V=0,2 L = 0,2.10-3 m3
s = 213,05 X (s en S.m-1)
8)Voir 1)
9)
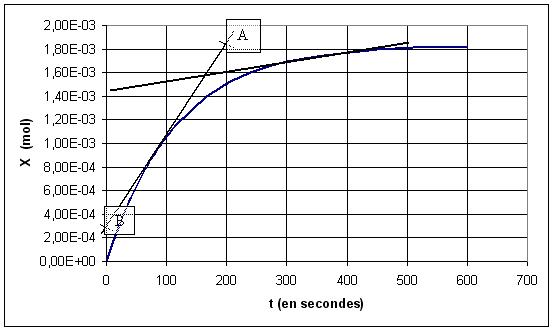
10)On trace la tangente à la courbe à t= 1 mn = 60 s . Soient A et B deux points de cette tangente . Les coordonnées de A sont tA= 200 s et XA=1,83.10-3 mol . Celles de B sont tB= 0 s et XB = 2,5.10-4 mol . Le coefficient directeur de cette tangente est par conséquent a= (XA - XB)/(tB-tA)= (1,83.10-3-2,5.10-4)/(200)=7,9.10-6 mol.s-1 .La vitesse de la réaction à t=1 mn est par conséquent v=a/Vsolution =7,9.10-6 mol.s-1/0,2 L = 3,95.10-5 mol.L-1.s-1 .
Une méthode similaire à partir de la tangente à t=6 mn = 360 s , nous permet de déterminer la vitesse à cet instant : v' = 4.10-6 mol.L-1.s-1 . v'< v : cela signifie que la vitesse de la réaction diminue au cours du temps .
11)La concentration du réactif 2-chloro-2-méthylpropane diminue au cours du temps . Celle-ci est un facteur cinétique : par voie de conséquence , la vitesse de la réaction diminue au cours du temps .
12) Le 2-chloro-2-méthylpropane étant le réactif limitant , Xmax est tel que 1,83.10-3 - Xmax = 0 mol , d'où Xmax = 1,83.10-3 mol .
13)Sur le graphe , l'avancement maximal correspond à l'asymptote . Nous lisons pour celle-ci X'max= 1,82.10-3 mol , ce qui correspond à la valeur trouvée précédemment à partir du tableau d'avancement .
14) La temps de demi-réaction est l'instant t1/2 pour lequel X= Xmax /2 . Nous trouvons ici t1/2 = 80 s