TP Titrage acide fort / base forte
Marériel
Burette, bécher, pipette, pH-mètre
Solutions:
Acide chlorhydrique , et soude décimolaires
I/Définitions :
*Dosage : permet de déterminer la concentration molaire d'une espèce chimique A présente dans une solution .
*Titrage : le dosage par titrage de l'espèce A consiste à la faire réagir avec une espèce titrante B .La transformation chimique correspondante doit être rapide et totale .
*Equivalence : elle est atteinte lorsque les ractifs ont été mélangés dans les proportions stoechiométriques de l'équation de dosage (changement de réactif limitant) .
II/Titrage d'un acide AH réagissant totalement avec l'eau :
a)La solution d'acide chlorhydrique :
HCl + H2O -------> H3O+ + Cl- réaction totale
Dans une solution d'acide chlorhydrique , il n'y a pas de HCl en solution .
Q1)Proposez une méthode qui permette de montrer que la réaction entre HCl et l'eau est totale (méthode pH-mètrique).
Q2)Recensez les espèces présentes dans une solution d'acide chlorhydrique .
b)La solution de soude NaOH :
NaOH --- eau ------> Na+ + OH- dissolution totale (solution non saturée)
Dans une solution de soude , il n'y a pas de "molécule" NaOH
Q3)Proposez une méthode qui permette de montrer que NaOH est entièrement dissocié dans l'eau (méthode pH-mètrique).
Q4)Recensez les espèces présentes dans une solution d'hydroxyde de sodium .
c)Titrage de l'acide chlorhydrique par la soude :
Q5)Décrivez le mode opératoire d'étalonnage du pH-mètre et étalonnez le pH-mètre.
* mode opératoire :
On ajoute Vb mL de solution de NaOH dans les 20 mL de solution d'acide chlorhydrique (+ BBT) .
Agiter , de façon à obtenir un mélange bien homogène.
Mesurer le pH
* Mesures

Vb (mL) |
0 |
1 |
3 |
5 |
10 |
15 |
18 |
18,5 |
19 |
19,5 |
20 |
20,5 |
21 |
21,5 |
22 |
24 |
26 |
30 |
pH |

Q6)Effectuer les mesures et remplissez sur votre copie un tableau identique à celui présenté ci- dessus .
* Tracer la courbe pH = f(Vb)
Q7)Tracez la courbe (courbe de titrage)
IV/Exploitation
a)Réaction entre l'acide chlorhydrique et la soude :
C'est en fait une réaction entre les ions H3O+ de la solution d'acide chlorhydrique et les ions OH- de la solution de soude :
H3O+ + OH- ---------> 2H2O
Celle-ci est appelée "Réaction de titrage"
Q8)Vérifier que la constante d'équilibre de la réaction de titrage a une constante d'équilibre élevée (> 104), ce qui prouve que la réaction est bien quantitative ( ou totale).
Q9)Etablir (en utilisant la définition de l'équivalence) qu'à l'équivalence , nous pouvons écrire : CAVA = CbVb,e , où Vb,e est le volume de soude versé à l'équivalence .
b)Equivalence
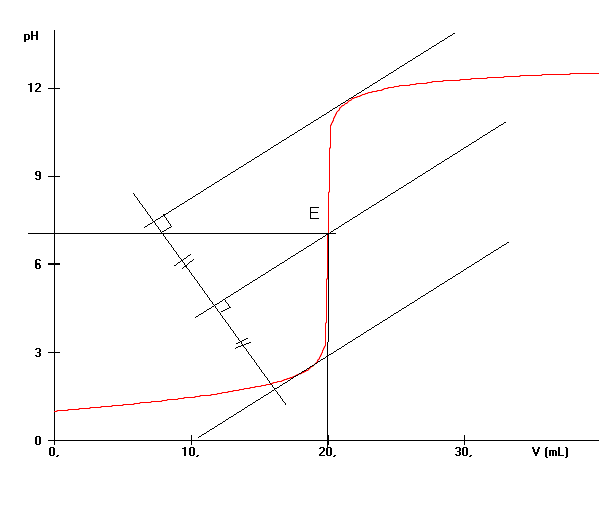
A partir de la courbe de titrage , le point d'équivalence peut être déterminé en utilisant la méthode des tangentes : voir livre fig 8 page 470
Q10)Déterminer les coordonnées du point d'équivalence..
V/Titrage colorimétrique :
a)Principe :
Il s'agit d'utiliser un indicateur coloré qui permette (sans pH-mètre) de déterminer Vb,e .
b)Dosage - utilisation des indicateurs colorés pour apprécier l'équivalence
L'utilisation du pH-mètre permet de suivre de manière précise l'évolution du pH lorsqu'on mélange une solution acide avec une solution basique .
Nous pouvons tirer parti de la courbe obtenue pour faire un choix judicieux de l'indicateur coloré à utiliser si l'on souhaite se contenter d'effectuer un dosage colorimétrique , donc sans pH-mètre.
L'utilisation d'un pH-mètre nous permet de déterminer Vb,e de façon relativement précise , ce qui est une nécessité si l'on veut déterminer Ca avec précision .
Qu'en est-il si au lieu d'utiliser un pH-mètre , on se contente d'utiliser un indicateur coloré ?
On utilise en lycée généralement trois indicateurs colorés (couple acido-basique dont les formes acide et base ont des couleurs différentes): l'hélianthine , le bleu de bromothymol (ou BBT) et la phénolphtaléine . Un indicateur coloré est caractérisé par sa zone de virage qui est déterminée par les valeurs extrêmes du pH entre lesquelles l'indicateur coloré change de teinte .
Exemples d’indicateurs colorés :
Indicateur |
Teinte |
Zone de virage |
Teinte |
pKa |
Hélianthine |
Rouge |
3,1 - 4,4 |
Jaune |
3,8 |
Bleu de bromothymol |
Jaune |
6,0 - 7,6 |
Bleu |
6,8 |
Phénol-phtaléine |
Incolore |
8,2 - 10,0 |
Rose |
9,6 |
Q11)Observer que les zones de virage coïncident approximativement avec avec les intervalles [pKa- 1, pKa+1] pour chacun des indicateurs colorés .

Le schéma
ci-contre permet de mettre en évidence le décalage entre le volume mesuré à
partir du changement de teinte de l'indicateur (de l'ordre de grandur de V ) et
le volume Vb,e à l'équivalence . Pour fixer les idées , nous
admettrons que l'incertitude relative avec laquelle est déterminé le point
d'équivalence en utilisant un indicateur dont la zone de virage est comprise
entre pH1 et pH2 est de l'ordre de ![]() .
.
Q12)Sur le graphe obtenus pH=f(Vb) à partir des mesures effectuées représenter les bandes qui correspondent aux trois indicateurs colorés cités
Nous retiendrons que l'indicateur en général le mieux adapté est celui dont la zone de virage "contient " le point d'équivalence . Cette remarque n'exclut pas toutefois la possibilité d'utiliser un indicateur qui ne satisfasse pas à ce critère et qui permette malgré tout d'effectuer une mesure précise .
Q13)La phtaléine permettrait-elle d'effectuer un titrage colorimétrique correct dans le cas de la réaction acide chlorhydrique/soude réalisée au cours du TP ?Justifiez votre réponse .
TP - titrage acide fort/base forte - Correction :
1)La réaction entre HCl et l'eau étant totale , le nombre de moles de HCl introduites (CA.V ) est égal au nombre de moles d'ions H3O+ présentes dans la solution ([H3O+] V ) , d'où CA= [H3O+] , ce qui donne pH= - log[H3O+] = - log CA . Autrement dit , dans le cas par exemple d'une solution décimolaire d'acide chlorhydrique , nous obtenons un pH = 1 (pour des raisons que nous n'expliquerons pas ici , en fait , le pH est plutôt de l'ordre de 1,1).
Si la réaction de HCl avec l'eau n'était pas totale , nous aurions [H3O+] < CA et donc pH > -log CA .
Nous pouvons par conséquent vérifier que la réaction de HCl avec l'eau est totale en mesurant le pH de la solution : Si la relation pH = - log CA est vérifiée , alors nous pouvons affirmer que la réaction est totale .
2)espèces : H3O+ , Cl- , H2O et OH- (H3O+ et OH- sont présents dans toutes les solutions aqueuses)
3)La dissolution de NaOH étant totale , le nombre de moles de NaOH introduites (CBV ) est égal au nombre de moles d'ions OH- présentes dans la solution ([OH-] V ) : CB= [OH-] , d'où [H3O+] = Ke/[OH-] = Ke/CB , ce qui donne log[H3O+]=log(Ke)-logCB ou -pH = -pKe -logCB et en définitive pH=pKe+logCB : Pour une solution décimolaire de soude par exemple , nous obtenons :pH=14+log(10-1)=13 .
Une mesure de pH permet par conséquent de vérifier que la dissolution de NaOH est totale .
4)Espèces : OH- , H3O+ , Na+ et H2O
5)Il faut rincer l'électrode et étalonner le pH-mètre en utilisant les solutions tampons pH=4 et pH=10. En général , il faut également "régler" la température .
6)
Vb (mL) |
0 |
1 |
3 |
5 |
10 |
15 |
18 |
18,5 |
19 |
19,5 |
20 |
20,5 |
pH |
1,1 |
1,1 |
1,2 |
1,2 |
1,5 |
1,8 |
2,3 |
2,4 |
2,6 |
2,9 |
7 |
11 |
21 |
21,5 |
22 |
24 |
26 |
30 |
11,4 |
11,5 |
11,7 |
11,9 |
12,1 |
12,3 |
7)
8) La réaction de titrage est H3O+ + HO- --->2H2O
K= 1/([H3O+][OH-]) = 1014 >> 104 . la réaction est donc totale
9)A l'équivalence : n(acide introduites) = n(soude versées)
ou CAVA = CBVb,e
10)La méthode des tangentes (fig 8 page 470 dans le livre) permet de déterminer E . Les coordonnées de E sont Vb,E = 20 mL et pHE = 7 .
11)Hélianthine: [pKa-1;pKa+1]=[2,8;4,8] avec une zone de virage comprise dans l'intervalle [3,1;4,4]
BBT : [pKa-1;pKa+1]=[5,8;7,8] avec une zone de virage comprise dans l'intervalle [6;7,6]
phtaléine : [pKa-1;pKa+1]=[8,6;10,6] avec une zone de virage comprise dans l'intervalle [8,2;10]
Il est claire que les zones de virage et les intervalles [pKa-1;pKa+1] sont très voisins.
12)

Il est clair qu'ici, les trois indicateurs permettent d'apprécier le volume versé à l'équivalence avec une bonne précision . Ils donnent tous les trois Vb,eq= 20 mL , ce qui correspond bien d'après la courbe pH-mètrique au volume de soude à verser pour atteindre l'équivalence .
13)D'après ce qui vient d'être écrit , nous pouvons constater que la phénolphtaléine (ou phtaléine) permet de réaliser un bon titrage colorimétrique .