TS - SYNTHÈSE DU PARACÉTAMOL
I. BUT
Préparer du paracétamol, purifier le produit brut et identifier le paracétamol formé.
II. PRÉPARATION
1. Principe
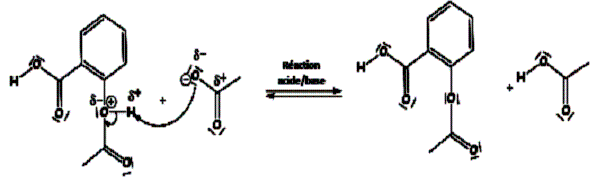
Elle est réalisée à partir de l'anhydride éthanoïque de formule (CH3 - CO)2 O et du 1-amino-4-hydroxybenzène (ou para-aminophénol)selon la réaction d’équation(1) :
(CH3-CO)2 O + NH2 - C6H4 - OH ---> CH3 - CO - NH -C6H4 - OH + CH3 - CO2H (1)
Cette réaction est exothermique.
2. Protocole
tableau de données :
état physique 25 °C, 1 bar |
densité |
température de fusion en °C |
température d’ébullition sous 1 bar en °C |
|
1-amino-4-hydroxybenzène |
solide |
186 |
||
composé A |
liquide |
1,08 |
- 73 |
136 |
acide éthanoïque |
liquide |
1,03 |
118 |
|
paracétamol |
solide |
171 |
Les masses molaires atomiques exprimées en g.mol-1 : M(H) = 1 ; M(C) = 12 ; M(N) = 14 ; M(O) = 16
-Dans un erlenmeyer de 100 mL introduiret successivement une masse m = 2,8 g de 1-amino-4-hydroxybenzène et 20 mL d'une solution d'acide éthanoïque à 2 mol.L-1 (mesurés à l'éprouvette). -Chauffer le contenu de l'erlenmeyer dans un bain marie à 80 °C , le mélange réactionnel étant agité jusqu'à dissolution complète.
-Après avoir refroidi le mélange, on introduit lentement sous la hotte un volume V = 3,5 cm3 de l'anhydride éthanoïque, tout en agitant.
-Placer l’erlenmeyer dans un bain d’eau glacée, le paracétamol formé, ou paracétamol brut (PB), précipite sous forme de cristaux.
-Filtrer les cristaux en utilisant le bũchner et la trompe à eau.
-Laver les cristaux avec un peu d'eau froide (arrêter l'aspiration d'eau , verser l'eau glacée sur les cristaux et remettre l'aspiration d'eau)
-Sécher les cristaux entre deux papiers filtres .
-Réserver une pointe de spatule du « paracétamol brut » dans un tube à essais.
III/RECRISTALLISATION
-Les cristaux de paracétamol brut sont ensuite dissous dans 20 cm3 d’eau bouillante(s'il reste des cristaux non dissous , ajouter très peu d'eau chaude).
-Refroidir ensuite dans un bain d'eau glacée jusqu’à la cristallisation, aussi complète que possible, du paracétamol recristallisé (PR).
-Filtrer au bũchner, laver à l’eau et sécher entre deux papiers filtre.
IV/CHROMATOGRAPHIE
On réalise une chromatographie du paracétamol recristallisé (PR) , du paracétamol brut (PB) et de paracétamol pharmaceutique (PF) avec pour éluant, un mélange (60 et 40 % en volume respectivement ) de dichlorométhane et d’éthanol.
On obtient le chromatogramme suivant :

Révéler à la lampe UV
V/QUESTIONS
Q1)Quelle est la signification des mots « analgésique » et « antipyrétique »
Q2)Donner les formules semi-développées (ou développées) des réactifs et des produits de la réaction.
Q3)Nommer les deux groupes caractéristiques portés par la paracétamol.
Q4) Donner également le nom et la formule du produit de la réaction qui accompagne la formation de paracétamol.
Q5)Faire le schéma annoté du montage de filtration sous vide du paracétamol.
Q6)Quel est l'intérêt de la trompe à eau pour filtrer ?
Q7)Justifier l'apparition du précipité de paracétamol lors du refroidissement dans le bain de glace .
Q8)Quel est l'intérêt de la recristallisation ?
Q9)Déterminer les quantités de matière des réactifs utilisés ?
Q10)Quel est le réactif limitant ?
Q11)Quelles sont les espèces chimiques contenues dans le filtrat ?
Q12)Proposer un protocole qui permette de calculer le rendement de cette synthèse. Proposez une formule qui permette de le calculer .
Q13)Interpréter le chromatogramme obtenu .
Q14)Représentez les formules de Lewis des réactifs et indiquez les sites nucléophiles et électrophiles .
VI/Mécanisme réactionnel de la réaction
Le schéma ci-dessous représente les différentes étapes de la réaction :

Q15)Représenter par des flèches courbes le mouvement des doublets d’électrons permettant d’expliquer la formation et la rupture des liaisons observées
CORRECTION TP Parécétamol
1/analgésique : qui agit contre la douleur
antipyrétique : médicament qui a tendance à faire baisser la fièvre
2/ Formule semi-développée de l'anhydride éthanoïque :

Formule semi-développée du para-aminophénol :

3/groupes caractéristiques du
paracétamol :

4/Le produit de la réaction qui accompagne la formation du paracétamol est l’acide éthanoïque. Sa formule semi-développée est :
![]()
6/La trompe à eau permet une filtration plus rapide et plus efficace qu'une filtration simple .
7/A chaud le paracétamol est soluble dans l'eau . Lorsque la température baisse sa solubilité diminue:d'où l'apparition du précipité lors du refroidissement dans le bain de glace.
8/La recristallisation permet de purifier le paracétamol brut obtenu dans un premier temps, en éliminant un certain nombre d’impuretés .Elle est fondée sur la différence de solubilité du produit que l'on souhaite purifier et des impuretés à chaud et à froid dans des solvants.
9)Les quantités de matière de l'anhydride éthanoïque et de C6H7NO introduites dans le milieu réactionnel sont :
nintroduit (anhydride) = ![]()
nintroduit (C6H7NO)
= ![]() = 2,6 . 10-2 mol
= 2,6 . 10-2 mol
D’après l'équation de la réaction, la relation stoechiométrique est :
nayant réagi (anhydride) = nayant réagi (C6H7NO)
10)On constate que l'anhydride éthanoïque est introduit en excès, ce qui signifie que la para-aminophénol est le réactif limitant.
11)L'anhydride étant introduit en excès, nous allons en retrouver dans le filtrat . Celui-ci contient également de l'acide éthanoïque (produit de la réaction et utilisé pour dissoudre le para-aminophénol)
12)Nous pouvons calculer la masse de paracétamol que l'on pourrait espérer obtenir dans l'hypothèse d'un rendement de 100 % :
m = nformé (C8H9 NO2) . M
avec nformé (C8 H9 NO2) = nintroduit ( C6H7NO) = 2,6 . 10-2 mol
soit m = 3,93 g
Pour connaître le rendement de la réaction il suffit alors de peser le paracétamol obtenu mobtenu .Le calcul du rendement peut alors se faire en calculant le rapport r=mobtenu/m.
(le rendement en TP est en général de l'ordre de 50%)
13)
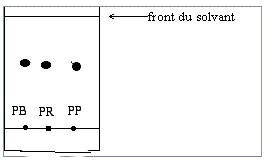
Résultat plutôt inattendu : le
chromatogramme obtenu a été constitué de trois taches situées au même niveau du
chromatogramme ce qui signifie que le paracétamol brut obtenu était déjà pur.
14)
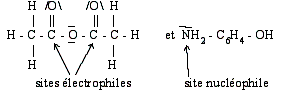
15)Mécanisme réactionnel :
*Mouvement des doublets d'électrons permettant d'expliquer la rupture des liaisons observées :

*Mouvement des électrons permettant d'expliquer les produits formés :
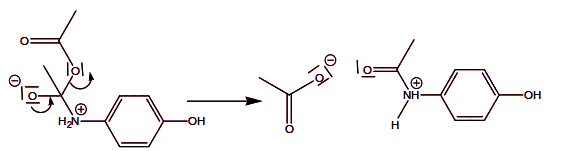
*Réaction acide-base