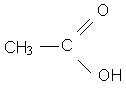
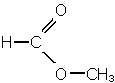
Exercice 3 page 122 :
Formules topologiques et formules brutes :
a. C5H10 b. C6H12O2 c. C6H12O2 d. C5H11NO
Exercice 4 Page 122 :
a. , b.
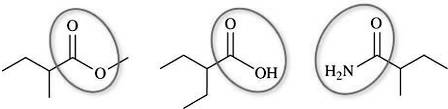
c. a est un alcène, b un ester, c un acide carboxylique et d une amide.
5. Exercice 5 page 122 :
a est le 2-méthylbut-2-ène
b est le 2-méthylbutanoate de méthyle
c est l'acide 2-éthylbutanoïque
d est le 2-méthylbutanamide
6. Exercice 6 page 122
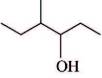
a. 4-méthylhexan-3-ol :
b. 3 -éthyl-2, 3 -diméthylheptanal :
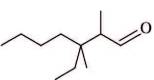
c.3,3,4-triméthylpentan-2-one :
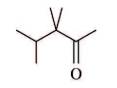
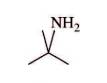
d.2-méthylpropan-2-amine :
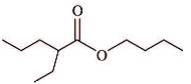
e. 2-éthylpentanoate de butyle :
Exercice 7 page 122 :
a. Les trois longueurs d'onde correspondant à un maximum d'absorption sont :
λ1 = 310 nm, l2 = 340 nm et l3= 530 nm.
b. l3 est une longueur d'onde du visible : vert . Cette couleur est absorbée par l'éosine . La couleur complémentaire du vert étant le rouge-pâle , cette couleur est celle de l'éosine en solution.
c.Amax = 1,1
La loi de Beer s'écrivant A = e(l)*c*L , nous en déduisons emax = 1,1/(1*10-5)=1,1.105 L.mol-1.cm-1 , ce qui corerspond (>103) à une absorption assez importante .
Exercice 8 page122:
a.Aux alentours de 3 350 cm-1 nous avons une très forte absorption et la bande est large :il s'agit de O-H du groupe hydroxyle. Cette bande met en évidence l'existence de liaisons hydrogène en phase condensée.
b. On n'observe plus qu'une bande fine vers 3600 nm : en phase gazeuse , il n'y a plus de liaisons hydrogène .
Exercice 11 page 123 :
a.Le tableau d'absorption en spectroscopie infrarouge en tenant compte des atomes constituants des molécules, nous permet d'observer que les nombres d'onde indiqués 3080 cm-1 et 1710 cm-1 correspondent respectivement à l'existence de liaisons O-H lié (liaison hydrogène) et C=O .
A priori , nous pouvons envisager les formules :
|
|||
|
|||
Les formules topologiques correspondantes sont :
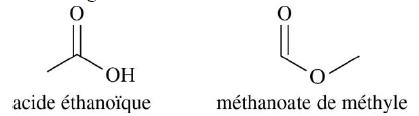
b.Le spectre infrarouge montre la présence de la liaison O-H . La bande correspondante large permet de confirmer qu'il s'agit d'un groupement OH d'un acide carboxylique . La molécule en question est par conséquent celle de l'acide éthanoïque .
Exercice 14 page 125 :
a. Nous avons une bande à environ 1 700 cm–1, correspondant à la liaison C=O. La bande un peu plus large aux alentours de 3 000 cm–1 correspond certainement une liaison C-H. En revanche, la dernière bande, de faible absorption aux alentours de 3 500 cm–1 peut tout aussi bien être attribuée à la liaison O-H qu'à la liaison N-H.
b.Il faut donc renseignement concernant la nature des atomes de la molécule : combien contient-elle d'atomes d'oxygène et/ou d'azote ? L'analyse élémentaire peut apporter ce renseignement.
c.La bande à 3 500 cm-1 correspond donc à la liaison N-H (en phase gazeuse). Et on a dit qu'elle possédait aussi une liaison C=O.
Deux classes fonctionnelles sont définies à partir de la présence d'une liaison N-H : celle des amides et celle des amines. Deux groupes caractéristiques (au programme) contiennent la liaison C=O avec un unique atome d'oxygène : le groupe carbonyle et celui associé aux amides. La molécule étudiée ici peut donc être une amide (et c'est le cas : l'éthanamide), mais il peut aussi s'agir d'une molécule polyfonctionnelle, c'est-à-dire qui appartient à au moins deux classes fonctionnelles : amine + aldéhyde ou amine + cétone.
Exercice 16 page 126 :
a.
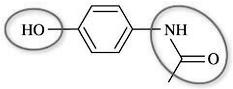
OH est le groupe hydroxyle. L'autre groupe entouré est le groupe amide.
b.OH est le groupe hydroxyle (correspond ici à une fonction phénol).
c.Cette molécule appartient à la classe des amides .
d.Le paracétamol n’absorbe que des radiations du domaine de l’UV. La solution n’apparaît donc pas colorée.
e.Bande a à 3600 cm-1 : correspond à la liaison O-H.
Bande b à 3400 cm-1 : correspond à la liaison N-H.
Bande c à 3000 cm-1 : liaisons C-H
Bande d à 1700 cm-1 : liaisons C=O.
Bande e à 1500 : liaisons C=C
f. En phase condensée, il apparaîtra une bande très large et de forte absorption centrée aux alentours de 3 300 cm–1, correspondant aux liaisons hydrogène impliquant à la fois des liaisons N-H et des liaisons O-H entre différentes molécules présentes en solution.
Exercice 21 page 127 :
a. Ces deux molécules possèdent un groupe carbonyle C=O (fonction aldéhyde) et une liaison double C=C caractéristique des alcènes .
b. Dans le but-2-énal, les deux doubles liaisons C=C et C=O sont conjuguées (séparées par une liaison C-C).
c. D'après les tables : a correspond aux liaisons C-H ; b correspond à la liaison C=O ; c correspond à la liaison C=C.
d. La conjugaison des doubles liaisons déplace par conséquent les nombres d'onde du minimum des bandes d'absorption vers de plus faibles valeurs.
Exercice 26 page 129 :
1. a. Non, nous ne pouvons pas parler de la couleur des ions triodure en solution dans la mesure où les 5 tubes ont des couleurs différentes qui dépendent des concentrations en I3- .
b. Amax = 0,80 pour une valeur de longueur d'onde lmax = 350 nm (environ).
On en déduit par la loi de Beer-Lambert A = e(l)*L*c , emax= Amax/(L*c) =6,2 10 L.mol.cm-1 .
c.Les ions triiodure sont donc fortement absorbants essentiellement dans l'UV, mais la courbe montre qu'ils sont absorbants également dans le bleu-violet (400-500 nm) dont la couleur complémentaire est le jaune . La solution a donc une couleur jaune, du moins à la concentration indiquée en ions I3- .
d.D'après la loi de Beer-Lambert, l'absorbance A est proportionnelle, pour chaque longueur d'onde, à la concentration en ions triiodure en solution. Si cette dernière augmente, l'absorbance augmente. L'absorbance augmente notamment pour les longueurs d'ondes plus élevées . Cela est confirmé par l'évolution de la couleur des solutions lorsqu'elles sont de plus en plus concentrées. Si nous considérons la solution de concentration c4 , celle ci-est pratiquement rouge pâle , ce qui signifie que la solution absorbe notamment la couleur cyan.
e.Pour une solution très concentrée la solution est presque noire (rouge-brun plus exactement) , ce qui signifie que pratiquement toutes les couleurs du visible sont absorbées .
2. a. On relève un maximum d'absorption Amax = 0,12 pour une longueur d'onde lmax = 430 nm. On en déduit, par la loi de Beer-Lambert : e(lmax)= = 4,8 L.mol-1-cm-1
b.λm = 430 nm correspond à des radiations de couleur bleue. .La couleur complémentaire est donc le jaune. Si l'on ne prend pas en compte l'autre pic d'absorption vers 700 nm , la solution devrait être jaune.
c.L'absorption n'est pas intense puisque e(lmax) est inférieur à 102 L.mol-1.cm-1.
d. On constate clairement que la couleur du sulfate de nickel n'est pas jaune, mais verte ! On n'a pas pris en compte l'existence de l'autre bande du spectre, aux alentours de 700 nm. Elle est certes moins intense, mais elle traduit l'absorption d'une bonne partie des longueurs d'onde correspondant aux radiations de couleur rouge. La couleur perçue de la solution correspond en fait à celle des radiations visibles les moins absorbées (et donc transmises), correspondant au minimum d'absorption, aux alentours de l = 550 nm. La solution paraît effectivement verte.
Exercice 28 page 130 :
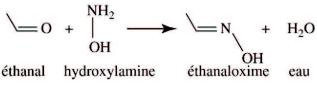
a.L'éthanal a pour formule brute C2H4O, l'hydroxylamine NH3O, et l'éthanaloxime C2H5NO. On s'aperçoit donc que pour que la conservation de la matière soit respectée, la production d'une molécule d'éthanolamine s'accompagne de celle d'une molécule d'eau H2O.
C2H4O + NH3O ---> C2H5NO + H2O
Soit en utilisant les formules topologiques :
b.
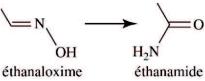
Les deux molécules ont la même formule brute mais des formules développées différentes : ce sont donc des isomères , d'où l'appellation "réaction d'isomérisation".
c. B : Pas d'absorption correspondant à la liaison C=O (à 1700 cm-1), donc pas de liaison C=O : il s'agit du spectre de l'éthanaloxime . Cela est confirmé par une absorption intense mais fine vers 3500 cm-1
On y distingue au passage la bande fine (mais intense) caractéristique, en phase gazeuse de la liaison O-H.
A : Mise en évidence de la liaison N-H par une légère absorption à 3450 cm-1 et 3550 cm-1 .
C: Par élimination , l'éthanal.
Exercice 3 page 142 :
a. Il y a deux formules semi-développées correspondant à la formule brute C2H4O :
b. Le signal à 9,79 ppm correspond ici à un proton lié à un groupe carbonyle (Un composé carbonylé est un composé organique comportant une double liaison entre un atome de carbone et un atome d'oxygène, l'atome de carbone étant lié exclusivement à des atomes d'hydrogène ou de carbone. En effet, bien qu'une liaison C=O soit présente dans les fonctions esters ou les acides carboxyliques et leurs dérivés, on parle dans ce cas de groupe carboxyle). La molécule étudiée est donc l'éthanol CH3–CH=O.
Remarque : en fait, on pouvait conclure sans la table de déplacements chimiques. Des deux molécules possibles, l'éthanal est la seule qui possède deux types de protons ; dans l'autre molécule, tous les protons sont équivalents et donneraient donc lieu à un seul signal.
Exercice 4 page 142
a. Il n'y a qu'un seul signal, donc un seul groupe de protons équivalents. Autrement dit, tous les protons de la molécule sont équivalents.
b.Dans la molécule proposée CH3-O-CH3 les 6 protons sont manifestement équivalents : les trois protons portés par chaque carbone sont équivalents , qui eux-mêmes sont équivalents aux trois autres portés par l'autre carbone en raison de la symétrie de la molécule .
Exercice 5 page 142
a. Le spectre comporte trois signaux : il y a donc trois groupes de protons équivalents dans la molécule, ce qui est cohérent avec la formule de la molécule d'éthanol : CH3–CH2–OH : un signal pour les protons de CH3 , un signal pour ceux de CH2 et un pour celui du groupe OH .
b. Vers 1 ppm nous avons un triplet : cela correspond à un proton du groupe CH3 (2 voisins dans CH2).A 3,5 ppm nous avons un quadruplet : cela correspond à un proton du groupe CH2 (3 voisins dans CH3) .A 1 ppm , cela correspond au proton du groupe OH (un seul proton)
Nous observons qu'à 1 ppm , le saut de la courbe d'intégration est 3 fois plus grand qu'à 5,5 ppm , ce qui correspond bien aux trois protons équivalents du groupe CH3 . A 3,5 ppm , 3 protons équivalents (saut de la courbe d'intégration deux fois plus important qu'à 5,5 ppm)
Exercice 6 page 143
a. Les réponses ont déjà été données dans l'exercice précédent : vers 1 ppm : un triplet , vers 3,5 ppm : un quadruplet .
b. voir l'exercice précédent . Tout est cohérent .
Exercice 7 page 143
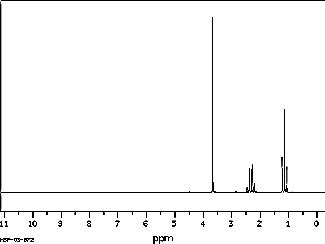
a. A 1,15 ppm : un triplet . A 2,32 pm : un quadruplet Les trois protons du signal à 1, 15 ppm ont deux protons voisins : le signal à 1, 15 ppm a donc 2 + 1 = 3 pics, c'est un triplet. A 3,67 ppm , un singulet .
Pour le détail , voir le cours.
b.
Exercice 20 page 146
*Le spectre de l'exemple étudié fait apparaître 3 signaux : la molécule contient trois types de protons.
Nous pouvons donc éliminer le propan-1-ol, qui a 4 types de protons : CH3 — CH2 — CH2 — OH
*Analysons à présent la courbe d'intégration.
A 4 ppm : hauteur du palier de 1 (1 proton) , également à 2 ppm . A 1 ppm , hauteur du palier de 6. On peut donc penser que la molécule contient un multiple de 8 protons . Quelle que soit la molécule considérée parmi les trois , elles contiennent toutes 8 protons .
*la multiplicité des signaux :
Or d'après la spectre , la molécule contient 3 groupes de protons équivalents : 1 à 4 ppm , 1 à 2 ppm et 6 à 1 ppm .Un proton dont le spectre présente des pics à 4 ppm a 6 voisins équivalents (6+1 pics) . Un proton dont le spectre présente deux pics (1+1) à 1 ppm . Cela peut correspondre à la molécule de propan-2-ol qui est , des deux molécules non éliminées la seule à avoir 6 protons voisins équivalents .

Remarque :Le singulet à 2,1 ppm correspond au proton du groupe hydroxyle : ce proton n'est pas considéré comme voisin des autres protons de la molécule lorsque le tube de mesure contient des traces d'eau (ce qui presque toujours le cas).
Vérifions la cohérence des conclusions précédentes avec une table de déplacements chimiques : sur le spectre donné, le signal à 4,0 ppm (septuplet) correspond au proton situé sur le même atome de carbone que le groupe hydroxyle : on est bien dans la fourchette [3,1 ppm - 4,0 ppm] des protons sur un atome de carbone lié à un atome électronégatif.
Le signal à 2,1 ppm peut bien être celui du proton d'un groupe hydroxyle, et celui à 1,2 ppm correspond bien à des protons sur une chaîne carbonée linéaire.
Exercice 22 page 146
a. La hauteur du saut de la courbe d'intégration est proportionnelle au nombre de protons responsables du signal : le triplet correspond donc à = 1,5 fois plus de protons que lequadruplet.
On note n le nombre de protons responsables du triplet et n' le nombre de protons responsables du quadruplet : n = 1,5 n'
La formule brute de la molécule étant C4H10O, on a aussi :
n + n' = 10
On en déduit : 1,5 n' + n' = 10, soit 2,5 n' = 10, soit n' = 4
Donc : n = 1,5 ; n' = 6
Le triplet correspond donc à 6 protons et le quadruplet à 4 protons.
b. Le triplet correspond à des protons ayant deux protons voisins, et le quadruplet correspond à des protons ayant trois protons voisins : on reconnaît l'association des deux signaux
caractéristique du groupe éthyle CH3–CH2–.
Le triplet correspondant à 6 protons et le quadruplet correspondant à 4 protons, la cétone étudiée a vraisemblablement un plan de symétrie, et est donc l'éthoxyéthane :
CH3–CH2–O–CH2–CH3
Remarque : le signal correspondant aux protons des –CH2– (quadruplet à 3,4 ppm) a un déplacement chimique supérieur à celui du signal des protons des –CH3 (triplet à 1,1 ppm), car les –CH2– sont plus proches de l'atome le plus électronégatif de la molécule, l'atome
d'oxygène.
Exercice 24 page 147
a. Tous les protons sont équivalents entre eux , donc un seul pic (singulet)
b. Le TMS sert de référence : d=0 . Dans les autres molécules , d>0 en général . Cela signifie que dans ctee molécule le déplacement est plus faible que dans les autres molécules de la chimie organique .
c. Le choix du TMS comme référence est donc un bon choix .
Exercice 26 page 148
a. Hexan-2-one : CH3–(C=O)–CH2–CH2–CH2–CH3.
Hexan-3-one : CH3–CH2–(C=O)–CH2–CH2–CH3.
b.Seule l'empreinte digitale (s< 1500 cm-1) diffère pour les deux molécules . Mais cette nuance ne permet pas de les différencier.
c.La RMN devrait permettre de différentiel les deux molécules . L'hexane-2-one devrait donner 5 groupes de protons équivalents , tout comme l'hexan-3-one . Il y a par contre une différence avec le nombre de protons voisins , le groupe CH3 de l'hexan-2-one du coté de C=O n'ayant pas de protons voisins. Ce groupe de protons ne présente par conséquent qu'un pic (singulet) .
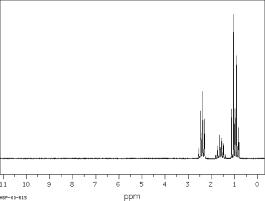
d. Spectre de RMN du proton de l'hexan-3 -one
:
Spectre de RMN du proton de l'hexan-2-one :
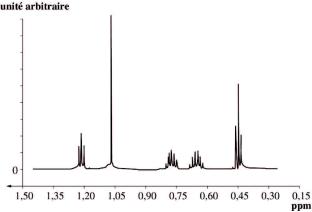
e. On observe bien un singulet dans le spectre de l'hexan-2-one alors que le spectre de l'hexan- 3-one ne comporte que des multiplets. On peut donc aisément attribuer l'un des deux spectres de RMN à l'hexan-2-one, et l'autre à l'hexan-3-one.
On remarque que le spectre de RMN de l'hexan-3-one ne fait pas apparaître distinctement 5 signaux : en effet, même si l'on compte 5 groupes de protons équivalents, des protons non équivalents ont des environnements chimiques très similaires, et donc des déplacements chimiques très voisins.
Exercice 28 page 148
1. a. On trace la fonction δ = f(ν).
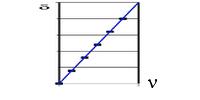
b. La fonction est de la forme δ = a x ν + b, avec a = 5,00.10-3 Hz–1 et b = –9,5. 105 ppm . Etant donnée la définition du déplacement , nous obtenons finalement d=(n-nref)/n0 * 106 = a*n
2. a. Les deux signaux apparaissent aux mêmes déplacements chimiques, indiqués sur l'axe des abscisses. L'écart entre les signaux est repéré par une double flèche en Hz, et non en ppm. Cela n'est pas gênant puisque , comme cela vient d'être vu ci-dessus ,la fréquence de résonance et le déplacement chimique sont liés par une relation simple.
b. Le déplacement chimique ne dépend pas du spectromètre utilisé, contrairement à la fréquence de résonance. Mettre le déplacement chimique en abscisses des spectres permet de comparer aisément des spectres effectués sur des appareils différents.
Exercice 29 page 149
* Trois singulets ce qui est lié au fait que les protons n'ont pas de proches voisins .
* Le signal à 2,2 ppm peut correspondre aux protons du groupe CH3 . Difficile de dire pour les autres sans disposer d'une table plus complète que celle du livre .