TRANSFORMATIONS LENTES OU RAPIDES
I/La concentration des réactifs :
a)Expérience : le soleil couchant .
S1 : solution de thiosulfate de sodium Na2S2O3 à 0,25 mol.L-1
S2 : solution d'acide chlorhydrique 1 mol.L-1 .
On prépare trois béchers qu'on dispose sur un rétroprojecteur , les contenus des béchers étant :
B1 : 20 mL de S1 + 40 mL d'eau
B2 : 30 mL de S1 + 30 mL d'eau
B3 : 40 mL de S1 + 20 mL d'eau
A un instant t=0 on ajoute simultanément dans chaque bécher 5 mL de solution S2 .
Constatation : Le "soleil" se couche plus rapidement avec le bécher B3 que le bécher B1 .
La réaction conduit à la formation de soufre : S2O32- + 2H3O+ ------> S + 3H2O + SO2
Conclusion : La vitesse de formation du soufre est plus importante dans le bécher 3 que dans le bécher 2 , la vitesse de formation du soufre dans ce dernier étant elle même plus importante que dans le bécher 1 .
b)Loi des concentrations :
La vitesse de formation ou la itesse de disparition d'un corps augmentent avec la concentration des réactifs .
Dans l'expérience réalisée : [S2O32- ]B3 > [S2O32- ]B2 > [S2O32- ]B1 : Le soufre se forme plus rapidement dans le bécher (3) que dans le bécher (2) .....
II/La température :
a)Expérience :
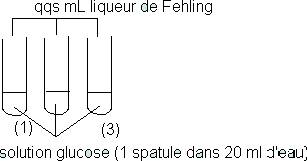
On place :
* le tube 1 dans la glace fondante (0°C)
* le tube 2 dans l'eau chaude
* le tube 3 à température ambiante .
Constatation :C'est dans le tube 2 que la réaction est la plus rapide .
b)Loi de la température :
En général , les vitesses de formation d'un produit ou de disparition d'un réactif augmentent avec la température .
c)Application : blocage cinétique
III/Facteurs cinétiques :
Les paramètres dont dépend la rapidité d'une réaction chimique sont appelés "Facteurs cinétiques" :Les concentrations des réactifs et la température sont des facteurs cinétiques .
Microscopiquement la vitesse d'une réaction chimique dépend notamment des quantités de collisions et de l'efficacité de ces collisions entre les réactifs .
* Plus la concentration des réactifs est élevée , plus la quantité de chocs par unité de temps est importante (réaction plus rapide)
* Plus la température est élevée , plus la vitesse des molécules est élevée et donc les chocs plus violents (réaction plus rapide)
Remarque : Le solvant peut également avoir une influence sur la vitesse d'une réaction : c'est donc également un facteur cinétique .
IV/Catalyse :
a)Définition :
Un catalyseur est une espèce chimique qui diminue la durée de réaction dans le milieu réactionnel où il est introduit . Il n'apparaît pas dans l'équation de la réaction .
b)Expérience :
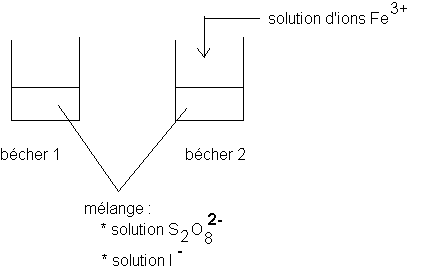
Le mélange des deux solutions d'ions peroxodisulfates et d'ions iodures initialement incolore devient progressivement jaune-brun .
L'évolution est manifestement plus rapide dans le bécher 2 que dans le bécher 1 .
interprétation :
* Réaction entre S2O82- et I-
Ecrivons tout d'abord les demi-équations électroniques des couples en présence :
S2O82- + 2e = 2 S2O42-
2I- = I2 + 2e
-----------------------------------------
S2O82- + 2I- -------> I2 + 2SO42- (1)
Cette équation est celle de la transformation chimique entre les ions S2O82- et les ions I- . La coloration jaune est due à la formation de I2 .
Cette réaction est lente .
* Influence des ions Fe3+ : ils augmentent la vitesse de la réaction (1) . Ces ions appartiennent au couple (Fe3+/Fe2+ ) et dans ce couple Fe3+ est un oxydant : Fe3+ + e = Fe2+ .
- On peut concevoir que l'oxydant Fe3+ réagit avec le réducteur I- :
2I- + 2Fe3+ -------> I2 + 2Fe+ (2)
- les ions Fe2+ formés (réducteur) réagissent à leur tour avec l'oxydant S2O82- :
S2O82- + 2Fe2+ --------> 2SO42- + 2Fe3+ (2)
Il est clair que la somme des réactions (2) et (3) donne la réaction (1)
Les ions Fe3+ catalysent la réaction (1) en remplaçant la réaction (1) par deux réactions plus rapides (2) et (3) . Le catalyseur participe à la réaction , mais il n'apparaît pas dans la réaction globale car il est régénéré .
c)Types de catalyse :
On distingue trois types de catalyse :
1)la catalyse hétérogène :
le catalyseur et les réactifs ne sont pas dans la même phase .
Exemple : synthèse de l'eau en présence de platine : le platine (solide) catalyse la réaction entre H2 et O2 qui sont en phase gazeuse .
2)la catalyse homogène :
Le catalyseur et les réactifs sont dans la même phase
Exemple : l'expérience de I
3)La catalyse enzymatique :
le catalyseur est une enzyme (protéine)
d)Spécificité et sélectivité d'un catalyseur :
1-Spécificité :
Un catalyseur catalyse certaines réactions et pas d'autres : un catalyseur est spécifique d'un réactif .
Exemple : le nickel est le catalyseur d'hydrogénation des alcènes en alcanes . Il ne permet pas par contre de catalyser l'estérification d'un acide carboxylique .
2-Sélectivité :
Un catalyseur peut orienter l'évolution d'un système chimique vers un état final différent de ce qu'il atteindrait avec un autre catalyseur .
Considérons une espèce A qui est susceptible de donner avec un autre réactif , des produits B1 et B2 dans deux réactions différentes :
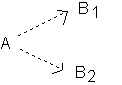
* un catalyseur C1 favorisera la formation de B1
* un autre catalyseur C2 favorisera la formation de B2
3-Remarque :
Un catalyseur ne peut pas rendre possible une réaction impossible !
V/Exercices:
page 272 et suiv : 3,5,6,7 et 28
Exercice résolu page 274