Les réactions en chimie organique
I/ Catégories de réactions
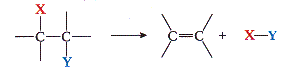
a. Substitution
Réaction chimique au cours de laquelle un groupe d'atomes (groupe sortant) est remplacé par un autre (groupe entrant).

X est remplacé par Y
b. Addition
Réaction chimique au cours de laquelle deux groupes d'atomes viennent se fixer sur les atomes initialement liés par une double ou triple liaison sans départ d'autres groupes d'atomes.
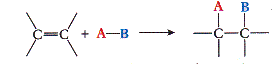
Exemple : Addition de chlorure d'hydrogène (HCl) sur un alcène
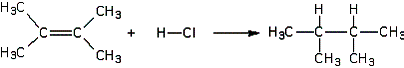
Au cours de cette addition, il y a rupture d'une liaison double C=C et d'une liaison simple H-Cl. Il y a également formation de deux liaisons simples C-Cl et C-H.
c. Elimination
Réaction chimique au cours de laquelle deux groupes d’atomes portés par des atomes voisins sont retirés d'une molécule sans arrivée d'autres groupes d'atomes. Il se forme une liaison multiple.
Exemple :la déshydratation d'un alcool conduit à un alcène . Ecrire la réaction des ions hydroxyde avec le propanol sachant qu'on obtient le prop-1-ène et de l'eau .
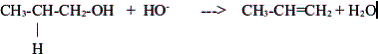
III/Aspect microscopique
1. Polarisation des liaisons
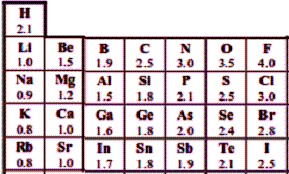
1)Electronégativité L'électronégativité (notée ) d'un atome traduit sa capacité à attirer le doublet d'électrons d'une liaison dans laquelle il est engagé.
Echelle d'électronégativité :(livre page 305)
 |
2/liaisons polarisées :
-la différence d'électronégativité entre des atomes permet
de prévoir la polarité des liaisons qu'ils forment entre eux.
-si les deux atomes sont différents, les électrons mis en commun sont attirés
vers celui ayant la plus grande électronégativité . Cette liaison est polaire
ou polarisée .
-l'atome le plus électronégatif possède un excès de charge négative et le moins électronégatif un excès de charge positive. Ces excès de charges s'appellent « des charges partielles », on les note d.
-si les deux atomes sont identiques , la liaison est apolaire .
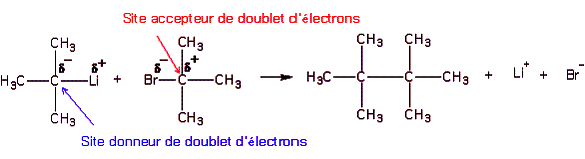
3/Site donneur et site accepteur d'électrons
-un site donneur d'électrons est un atome portant une charge partielle négative ou ayant des doublets non liants (site nucléophile – qui aime les charges positives). Un atome de carbone possédant une double liaison C=C constitue également un site donneur d'électrons.
-un site accepteur d'électrons est un atome portant une charge partielle positive, ce qui correspond à un défaut d'électrons (site électrophile – qui aime les sites chargés négativement). Un atome de carbone possédant une double liaison C=C ou un atome possédant une lacune électronique sont également des sites accepteurs d'électrons .
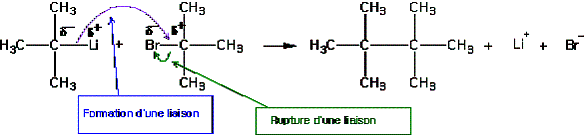
4/Transfert de doublets d'électrons :
Une réaction chimique ne peut se produire que si elle met en jeu un site donneur et un site accepteur :
Rupture et formation de liaisons (exemple)
IV/Exercices :
Pages 312 et suivantes :4,5,6,8,9,10,11,22 et 30