ANALYSE SPECTRALE
Exercices d'application immédiate à télécharger : cliquer ici
I/Généralités:
a)Spectre électromagnétique
b)Notion de résonance
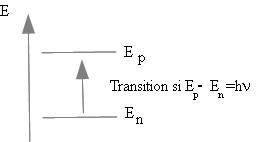
Les phénomènes de résonance existent dans un très grand nombre de domaines de la physique. Nous pouvons prendre l'exemple de l'atome : celui-ci possède un grand nombre d'états (quantifiés) d'énergie .
Des photons ne peuvent être absorbés par les atomes que si leur énergie E=h n est égale à la différence d'énergie entre deux niveaux de l'atome . Il s'agit d'un processus résonant .
II/spectres UV-visibles
a)Principe :
On utilise un spectrophotomètre pour réaliser ces spectres :

I0 : intensité du faisceau lumineux incident
I : Intensité du faiseau transmis.
Dans le domaine UV-visible , les transitions sont essentiellement d'origine électronique au sein des atomes .
spectre UV-visible : Absorbance A=f(l) avec A = lg (I0/I)
Loi de beer-Lambert : l'échantillon à analyser se trouve dans une cuve d'épaisseur L (épaiseur de la solution traversée). Si C est la concentration de l'espèce absorbante dans la solution alors nous avons :
A = e(l)*L*C .
e(l) est appelé « coefficient d'absorption molaire » : celui-ci dépend de la longueur d'onde .
Animation:DSMHTS (spectrophotomètre)
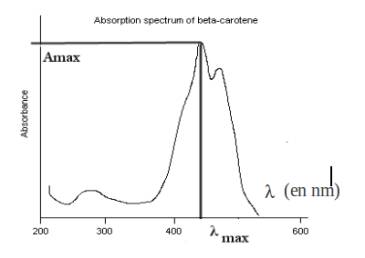
b)Exemple : spectre d'absorption de la molécule b-carotène
lmax se situe dans le bleu-violet (430 nm) , autrement dit c'est le bleu-violet qui est le plus absorbé. Le b-carotène est donc de la couleur complémentaire au bleu-violet :
 |
L'étoile des couleurs complémentaires montre que le b-carotène est de couleur jaune orangé (les couleurs complémentaires sont opposées sur l'étoile ).
APPLICATION 1
c)Lien entre couleur perçue et structure chimique :
*doubles lisons C=C conjuguées (groupes chromophores) : si elles sont séparées par une simple liaison carbone- carbone
*on constate que plus la conjugaison augmente , plus la longueur d'onde d'absorption augmente .

III/Spectroscopie infrarouge :
a)Principe :
Elle permet d'identifier les groupes fonctionnels d'une molécule . Nous pouvons donc l'utiliser pour identifier un produit inconnu .
On représente la transmittance T (en%) en fonction du nombre d'onde s :
T=I/I0 s=1/l l en cm et s en cm-1 . ( ! l'axe des abscisses est habituellement gradué de gauche à droite)
fig 13 – livre page 118 :

b)Origine du spectre :
les atomes d'une molécule ne sont pas fixes : ils vibrent .Les vibrations peuvent correspndre à une élongation longitudinale (vibration de valence) ou angulaire (vibration de déformation) :
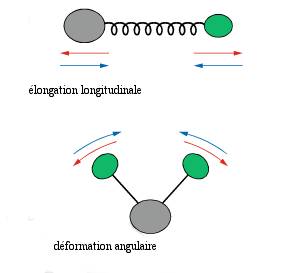
Les vibrations de liaison d'une molécule sont à l'origine de son spectre infrarouge .
c)Interprétation des spectres IR :
*Deux zones existent dans un spectre infrarouge
-entre 400 et 1400 cm-1 : elle est caractéristique de la molécule (on parle d'empreinte digitale) , mais cette zone est généralement délicate à interpréter.
-Une zone entre 1400 et 3500 cm-1 : elle permet d'identifier des signaux caractéristiques de liaisons ou de groupes caractéristiques .
Plus une liaison est forte , plus le nombre d'onde augmente
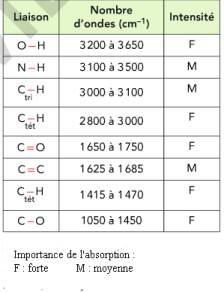 |
APPLICATION 2
Voir livre rabat du livre: Table de données spectroscopiques
-« tri » signigie « trigonal » : carbone lié à un autre carbone par une double liaison par exemple (angle de 120°)
-« tet » signifie tétragonal : carbone de la molécule de méthane par exemple (angle de 109°)
d)Influence de la liaison hydrogène :
La liaison hydrogène :
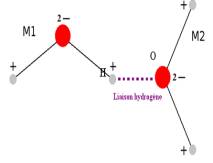 |
C'est une liaison de type dipôle-dipôle . Elle est de basse intensité (vingt fois plus faible qu'une liaison covalente classique), et relie des molécules en impliquant un atome d'hydrogène.
-la bande d'absorption (3600 cm-1 ) correspondant à la liaison O-H est habituellement étroite lorsqu'elle est observée en phase gazeuse.
-En phase condensée , la bande est plus large avec une forte absorption à 3300 cm-1 .
Fig 17 livre page 119
IV/Spectres RMN
a)Schéma de principe :
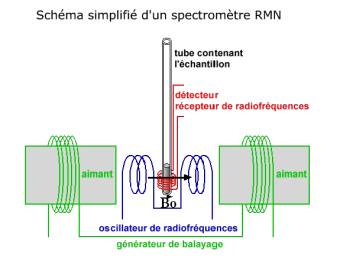
Cette technique permet de détecter l'environnement d'un noyau d'hydrogène . Pour obtenir un spectre RMN du proton , on place l'échantillon dans un champ magnétique et on le soumet simultanément à un rayonnement électromagnétique du domaine des ondes radio .
Ce champ magnétique permet de lever la dégénerescence du niveau d'énergie d'un proton . Sans champ magnétique , un seul niveau d'énergie , avec un champ magnétique : deux niveaux et l'intervalle entre les niveaux est proportionnel au champ magnétique B0 .
Dès lors nous ferons résonner le proton avec une onde électromagnétique dans le domaine des radio-fréquences
c)Exemple de spectre RMN
spectre RMN de l'éthanol :
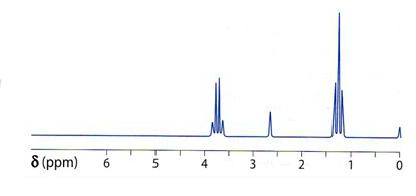 |
c)Déplacement chimique
![]()
di : déplacement chimique (en ppm c.a.d. partie par million)
nref : fréquence de référence ou fréquence de résonance du proton libre (lorsqu'il est « seul », référence le tétraméthylsilane ou TMS Si(CH3)4 )
n0 = fréquence proportionnelle au champ magnétique B0 dans lequel est plongé l'échantillon .
ni : fréquence de résonance du proton dans son contexte , ce qui signifie que cette fréquence de résonance (donc le déplacement chimique , va dépendre de l'environnement du proton.
d)Blindage et déblindage .
*Si le proton qu'on veut faire entrer en résonance est entouré d'une densité électronique importante le proton ne « sentira » pas vraiment le champ magnétique B0 , mais un champ inférieur et donc la fréquence de résonance sera plus faible (donc le déplacement chimique également) que s'il n'y avait pas cette concentration électronique autour de l'atome d'hydrogène concerné : on parle de blindage .
*Si l'atome d'hydrogène a par contre un atome voisin très
électronégatif , celui-ci va avoir tendance à appauvrir le voisinage électronique du proton . Celui-ci aura donc
tendance à mieux « sentir » le champ ![]() : on parle alors de déblindage .
: on parle alors de déblindage .
Table des valeurs des déplacements chimiques doc 13 page 138 .
Remarque :
Attention :
Attention un recours trop schématique aux tables de déplacements chimiques. Les
valeurs qui y sont consignées ne représentent que des situations moyennes, de
sorte que dans les cas extrêmes, une accumulation d'effets peut conduire à des
valeurs inattendues.
d)Protons équivalents :
Des protons équivalents résonnent pour la même valeur de déplacement chimique d .
Exemples :
CH4 : les quatres protons sont équivalents
CH3-CH2-OH : les protons dans CH3 sont équivalents , ceux du CH2 sont équivalents . Par contre , les protons du CH3 et les protons du CH2 ne sont pas équivalents entre eux .
e)Intégration du signal :
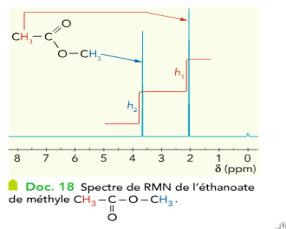 |
La courbe d'intégration d'un spectre RMN permet de déterminer le nombre de protons équivalents résonnants pour une valeur donnée du déplacement chimique d : ici h1/h2 = nombre de protons équivalents à 2 ppm / nombre de protons équivalents à 3,5 ppm = 3/3 = 1 .
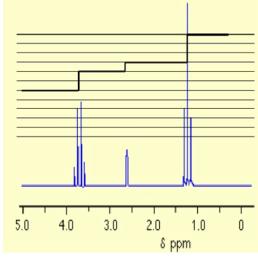 |
éthanol
e)Multiplicité du signal :
Pour un proton Ha possédant n voisins séparés de Ha par trois liaisons chimiques du type Ha-C-C-Hvoisin , la multiplicité du signal est m=n+1 . On obtient alors pour le proton Ha un signal constitué de n+1 pics appelé multiplet .
 |
Reprenons l'exemple du spectre de l'éthanol :
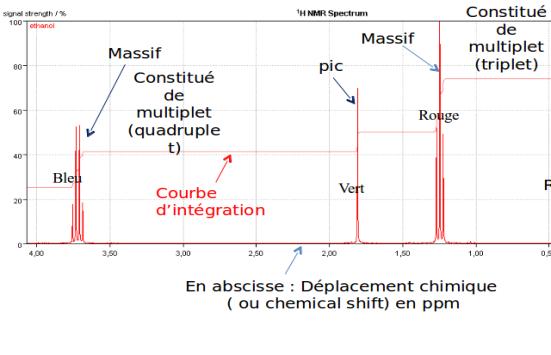
H : 2+1 multiplets = 3 multiplets ou triplet
H : 1 singulet
H : 1 quadruplet .
Intensités relatives des pics :
 |
Voir livre rabat : Table de données spectroscopiques
APPLICATIONS 3 et 4
V/Méthodes d'analyse à partir des différents spectres :
a)Spectre UV-visible :
L'étude de la courbe A= f(l) permet d'expliquer la couleur de la solution lorsque celle-ci est exposée à la lumière blanche : cette couleur est due aux radiations les moins absorbées .
b)Spectre infrarouge :
Il s'utilise principalement pour l'étude qualitative d'une molécule. Elle permet de mettre en évidence la présence de liaisons particulières .
1/Deux zones existent dans un spectre infrarouge :
2/Plus une liaison est forte , plus le nombre d'onde augmente.
3/la présence de liaisons hydrogène diminue la force de la liaison O-H (donc s diminue)
c)Spectre RMN :
Cette technique permet de détecter l'environnement des noyaux d'hydrogène . Nous pouvons ainsi avoir des renseignements sur la structure de chaînes carbonées .
Méthode d'analyse d'un spectre RMN :
1-Compter le nombre de signaux pour déterminer le nombre de groupes de protons équivalents .
2-Utiliser la courbe d'intégration pour déterminer la proportion de protons associée à chaque signal .
3-Analyser la multiplicité d'un signal pour dénombrer les protons équivalents voisins des protons responsables du signal .
4-Utiliser la table des valeurs de déplacements chimiques pour vérifier la formule de la molécule obtenue.
VI/Exercices :
-pages 122 et suivantes : 3,4,5,6,7,8,11,14,16,21,26 et 28
-Exercice résolu page 124
-pages 142 et suivantes:3,4,5,6,7,20,22,24,26,28 et 29
-Exercice résolu page 144
-Exercice 5 page 154