
TP CHIMIE : 2de - Le cuivre dans tous ses états
Objectif : Montrer la conservation de l'élément cuivre au cours de différentes expériences
I /Action de la soude sur une solution de sulfate de cuivre II
La solution de sulfate de cuivre contient des ions Cu2+ et des ions SO42- . La solution de soude contient des ions Na+ et des ions hydroxyde OH- . Les ions Na+ et les ions SO42- ne réagissent pas lorsqu'on mélange la solution de soude et la solution de sulfate de cuivre .
Dans deux tubes (noté l et 2) à essai, on verse 2 mL de solution de sulfate de cuivre. Dans le tube l, on ajoute quelques gouttes de soude.
Q1)Observation 1 :
Q2)Ecrire l'équation chimique entre les ions Cu2+ et les ions OH-
Il /Action de l'ammoniaque sur le précipité d'hydroxyde de cuivre II
Verser quelques millilitres de solution aqueuse d'ammoniaque dans le tube où s'est formé le précipité d'hydroxyde de cuivre II et agiter
Q3)Observation 2
La coloration bleue céleste à l'espèce chimique {Cu(NH3)4}2+
III /Retour à la solution d'ions Cu2+
Dans le tube précédent, ajouter une solution aqueuse d'acide nitrique jusqu'à disparition de la couleur bleue céleste. Verser de l'eau dans le tube 2 de façon à ce que les tubes l et 2 contiennent la même quantité de liquide.
Q4)Observation 3
IV/Electrolyse d'une solution de sulfate de cuivre.
Réaliser dans un tube en U, l'électrolyse d'une solution de sulfate de cuivre (électrodes en graphite, tension à 8 volts). Mettre quelques gouttes d'indigo à l'anode.
Q5)Observation 4. Faire un schéma
On obtient du dichlore Cl2 à l'anode (décolore l'indigo) . Du cuivre métal se forme à la cathode .
V /Passage du cuivre métal à l'oxyde de cuivre II
Chauffer à la flamme d'un bec bunzen une lame de cuivre que l'on tient avec une pince.
Q6)Observation 5 :Quelle est la couleur de la flamme , de la lame de cuivre ?
La lame devient rouge puis noire.
Le dioxygène de l'air a transformé le cuivre en oxyde de cuivre I Cu20 (rouge) et en oxyde de cuivre II CuO (noir)
VI/ Retour au cuivre à partir de l'oxyde de cuivre.
Mettre dans un tube à essai surmonté d'un tube à dégagement barbotant dans l'eau de chaux, de l'oxyde de cuivre II mélangé à de la poudre de carbone. Porter le mélange à l'incandescence en manipulant avec précaution .
Q7)Observation 6 . Faire un schéma
L'oxyde de cuivre s'est transformé en cuivre . L'eau de chaux est troublée, ce qui prouve la formation de dioxyde de carbone CO2 .
VII/ Passage du cuivre aux ions Cu2+
L'expérience est réalisée par le professeur
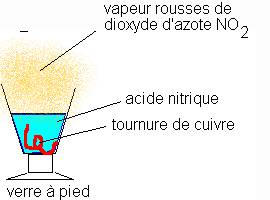
Sous la hotte, on met un petit copeau de cuivre dans un verre à pied et on verse de l'acide nitrique concentré
Observation 7
Le cuivre disparaît. La solution de teinte en bleue, il se forme des ions de cuivre II. Dégagement d'un gaz roux : c'est du dioxyde d'azote irritant.
VIII /Retour au cuivre
Placer une lame de fer fraîchement décapée dans un bêcher contenant une solution concentrée de sulfate de cuivre II CuSO4
Q8)Observation 8.
IX/Conclusion :

Q10)L'élément cuivre s'est-il conservé au cours des différentes transformations ?
X/Questions complémentaires :
a)Qu'est-ce qu'un corps simple ? un corps composé ?
b)Le cuivre est-il un corps pur ? L'hydroxyde de cuivre II Cu(OH)2 ?
c)Qu'est-ce qu'un ion ? un ion monoatomique ? un ion polyatomique ?
d)Conservation de l'élément soufre : L'élément soufre est présent dans le cycle de réactions suivantes :
*expérience 1 : la limaille de fer et la fleur de soufre jaune (poudre très fine) réagissent violemment l'un avec l'autre pour former un solide noir, le sulfure de fer FeS .
*expérience 2 : lorsqu'on verse de l'acide chlorhydrique sur le sulfure de fer, il y a dégagement d'un gaz malodorant, le sulfure d'hydrogène H2S.
*expérience 3 :Si on réalise la combustion du sulfure d'hydrogène à l'air , on obtient un dépôt jaune sur les parois du tube .
a)Réalisez un schéma légendé de chacune des trois expériences .
b)En quoi l'ensemble des trois expériences constitue t-il un cycle ?Que met en évidence ce cycle?
c)L'élément soufre a pour numéro atomique Z=16 . Donnez son nombre de protons et sa structure électronique .
d)Etablissez la structure électronique de l'anion sulfure S2- .
TP CHIMIE : 2de - Le cuivre dans tous ses états (correction)
1)

2)
Cu2+ + 2HO- ----> Cu(OH)2 , précipité
3)
Le précipité d'hydroxyde de cuivre II disparaît pour laisser place à un solution bleu-foncé (bleu de prusse)

4)
Les couleurs des deux tubes sont identiques , ce qui montre que nous avons retrouvé les ions Cu2+ que nous avions au départ .
5)

* à l'anode : l'indigo (ou l'encre) est décoloré par la formation de dichlore Cl2
* à la cathode , on observe le dépôt de cuivre sur l'électrode
6)Lorsqu'on chauffe une lame de cuivre à la flamme :
* la flamme a une teinte verdâtre
* la lame de cuivre prend une teinte rougeâtre (Oxyde de cuivre I Cu2O ) puis noirâtre (formation d'oxyde de cuivre II CuO).
7)

* du cuivre apparaît dans le tube chauffé
* l'eau de chaux se trouble , ce qui met en évidence le dégagement de CO2
Observation 7 :
L'expérience est faite sous la hotte . La solution d'acide nitrique initialement transparente devient bleue , ce qui indique la présence d'ions Cu2+
8)

La lame de fer se recouvre de cuivre
9)

10)L'élément cuivre est effectivement conservé au cours de ces transformations .
Exercices complémentaires :
a)Un corps simple est une espèce chimique dont la molécule est constituée d'un seul élément chimique ( ex : Cu, H2 , O2 )
Un corps composé est une espèce chimique dont la molécule est constituée d'au moins deux éléments chimiques différents (ex : H2O , Hcl)
b)Le cuivre est effectivement un corps pur . Cu(OH)2 n'est pas un corps pur .
c)Un ion est un atome ou un groupement d'atomes qui a gagné ou perdu un ou plusieurs électrons .Un ion monoatomique est constitué d'un seul atome ayant perdu ou gagné plusieurs électrons . Un ion ployatomique est constitué de plusieurs atomes , l'ensemble ayant perdu ou gagné plusieurs électrons .
d)-a:

d-b : S -----exp 1 ------> FeS -------exp 2 ----> H2S ------exp 3-------> S
On part de l'élément soufre dans l'expérience 1 et à la fin de l'expérience 3 on récupère du soufre : C'est la raison pour laquelle ces trois expériences constituent un cycle . Il est clair que l'élément soufre est conservé .
d-c : Z=16 : le noyau contient 16 protons ; structure électronique de l'élément soufre : (K)2(L)8(M)6
d-d : L'ion S2- a deux électrons de plus que l'atome de soufre . Sa structure électronique est donc :
(K)2(L)8(M)8 : c'est la structure électronique de l'argon Ar (gaz râre le plus proche) .