TP2 -CHIMIE :Extraction par un solvant
Matériel nécessaire : cristaux de diiode bisublimé ~ solution aqueuse de diiode ( qualitative ) - cyclohexane -
dichlorométhane - anis étoile en poudre ou broyé - coton hydrophile ( pour filtrer) - sulfate anhydre de
magnésium - l flacon étiqueté par groupe pour récupérer et conserver l'essence d'anis dans le dichlorométhane
pour une chromatographie future.
Par élève : bouchons pour tubes à essais - erlenmeyer 100 mL - ampoule à décanter + support anneau
On aura intérêt à mettre en place la manipulation du II l) avant d'aborder le paragraphe l .
I/ Principe de l'extraction par solvant
1) Rappels :
* solution : Une solution est obtenue par dissolution d'une espèce chimique dans un solvant . L'espèce chimique dissoute s'appelle soluté .
* solubilité : on appelle solubilité d'une espèce chimique, la quantité maximale de cette espèce que l'on peut dissoudre dans un litre de solvant .
2) Dissolution du diiode ( réalisée par le professeur) :
* Dans l'eau: dans un tube à essais, on introduit deux ou trois cristaux de diiode et on agite.
Q1)Observations
*Dans le cyclohexane : même manipulation
Q2)Observations
c) conclusion : un soluté donné est différemment soluble suivant les solvants proposés. Le diiode est plus
soluble dans le cyclohexane que dans l'eau.
3) Extraction du diiode d'une solution aqueuse
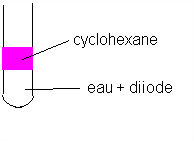
Dans un tube à essais 2 mL de solution aqueuse de diiode + lmL de cyclohexane. Agitater.
Q3)Faites un schéma , quelles sont vos observations .
Conclusion : l'espèce chimique rejoint le solvant dans lequel elle a la plus grande solubilité.
Il- Extraction de l'anéthole de la badiane ( anis étoilé )
1) Extraction
Dans un erlenmeyer de 100 mL introduire 10 mL de dichlorométhane ( flacon sous la hotte ) et 2 ou 3 spatulées d'anis étoile broyé ou en poudre. Placer un turbulent dans le mélange et placer l'erlenmeyer sur un agitateur magnétique. Laisser agiter environ 30 min.
Q4)Faites un schéma décrivant l'expérience .Quelles sont vos observations ?
Q5)Justifier, en utilisant le tableau de solubilités ci-dessous, l'extraction au moyen de dichlorométhane plutôt qu'à l'eau.
Solubilisé dans le dichlorométhane |
Solubilité dans l'eau |
|
Anéthole |
soluble |
insoluble |
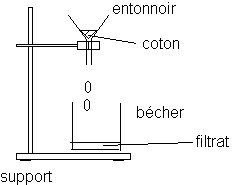
2) Filtration
En utilisant un peu de coton comme filtre, on filtre le mélange et on récupère le filtrat dans un petit bêcher.
3) Lavage
Observations et consignes d'utilisation d'une ampoule à décanter.
On verse le filtrat dans une ampoule à décanter et on ajoute 10 mL d'eau. Après agitation, en utilisant le
tableau, préciser ce que renferment les deux phases : aqueuse et organique et quelle est la phase inférieure.(densité du dichlorométhane d=1,34)
Q6)Faire un schéma annoté de l'ampoule à décanter avec les deux phases.
On récupère la phase organique dans un petit bêcher propre et sec.
4) Séchage
On verse une petite spatulée de sulfate anhydre de magnésium dans le petit bêcher et on remue doucement. On
laisse reposer et on verse doucement le liquide organique dans un flacon pour l'utiliser prochainement.
III/Questions complémentaires :
1)Deux liquides miscibles peuvent-ils être séparés en utilisant une ampoule à décanter ?
2)Définir la masse volumique d'un corps et sa densité par rapport à l'eau .
3)Faire un schéma légendé du dispositif utilisé pour réaliser une filtration .
4)Exercice 5 page 159
REPONSES (succinctes)
1)La solution prend une teinte très légèrement jaune .
2)On obtient une solution de couleur violette assez intense .
3)

Très rapidement , lorsqu'on laisse le tube à essais au repos , la phase aqueuse et la phase organique (cyclohexane) se séparent (le cyclohexane et l'eau ne sont pas miscibles).
La teinte jaune de départ de la solution aqueuse disparaît après le mélange , alors que le cyclohexanne prend une teinte violette assez intense .
Il est clair que du diiode est passé de la phase aqueuse à la phase organique , où il est beucoup plus soluble (voir expérience précédente).
4)

Au cours de l'agitation on a une solution de teinte brunâtre .
5)L'anéthole est davantage soluble dans le dichlorométhane que dans l'eau : il est donc préférable d'utiliser du dichlorométhane que de l'eau pour réaliser l'extraction .
6)La filtration a permis d'éliminer les particules solides . Nous mélangeons dans l'ampoule à décanter le filtrat (dichlorométhane + anéthole ) et de l'eau . L'eau et le dichlorométhane n'étant pas miscibles , lorsqu'on laisse reposer le mélange , les deux phases se séparent .
La phase inférieure est celle de dichlorométhane (contenant l'anéthole) car le dichlorométhane est plus lourd que l'eau (sa densité est supérieure à 1) . C'est cette phase que l'on récupère dans un bécher propre et sec .

Le sulfate de mégnésium anhydre utilisé ensuite permet d'éliminer les traces d'eau récupérées en même temps que la phase orgaznique .
Questions complémentaires :
1)Deux liquides miscibles se mélangent : ils ne peuvent donc pas être séparés dans une ampoule à décanter .
2)*La masse volumique d'un corps (homogène) est sa masse par unité de volume .Autrement dit , pour un corps de masse m et de volume V , sa masse volumique r est égale à :
![]() (Si la masse m est exprimée en kg et V en
litres , alors la masse volumique s'exprime en kg.L-1 )
(Si la masse m est exprimée en kg et V en
litres , alors la masse volumique s'exprime en kg.L-1 )
* La densité d'un solide ou d'un liquide se détermine par rapport à l'eau (pour les gaz , c'est l'air qui sert de référence) .
![]()
r est la masse volumique du corps considéré et reau la masse volumique de l'eau (pris dans les mêmes conditions de pression et de température). La densité est égale au rapport de deux grandeurs de même nature : c'est donc une grandeur sans dimension .
3)Filtration :
4)Exercice 5 page 159
a)* cas de l'eau : D'après le tableau , on peut dissoudre 0,30 g de diiode dans 1 litre d'eau .Pour dissoudre 1 g il faut x litres de d'eau . Le tableu de proportions suivant , nous permet de calculer x :
0,30 g |
1 Litre |
1 g |
x litres |
Autrement dit (produit en croix ) : x * 0,3 =1 et donc x=1/0,3 = 3,3 L
Il faut 3,3 L d'eau pour pouvoir dissoudre 1 g de diiode .
* cas des autres solvants :
les résultats sont rassemblés dans le tableau suivant :
solvant |
eau |
éther |
chloroforme |
sulfure de carbone |
V pour dissoudre 1 g de I2 |
3,3 L |
4 mL |
21 mL |
6 mL |
b)Le solvant le mieux adapté pour extraire du diiode d'une solution aqueuse est l'éther (c'est dans l'éther que le diiode est le plus soluble) .