LES MOLECULES (Questions et exercices) :
1)Pourquoi les molécules se forment-elles ?
2)Qu'est-ce qu'une liaison covalente ?
3)Qu'est-ce qu'un doublet liant ?
4)Qu'est-ce qu'un doublet non liant ?
5)Quand dit-on que deux molécules sont deux isomères (de constitution) ?
6)Quelle est la différence entre une formule brute et une formule développée ?
7)Une liaison covalente est constituée d'un doublet d'électrons provenant : (répondre par vrai ou faux à chacune des affirmations ):
a-de la couche externe d'un atome
b-de la couche interne d'un atome
c-des couches externes de deux atomes .
8)Une liaison covalente lie : (répondre par vrai ou faux à chacune des affirmations ) :
a-deux atomes
b-plusieurs atomes
c-deux ions .
9)Stabilité chimique :
a-les atomes suivants sont-ils stables ? ![]()
b-les atomes stables forment-ils facilement des ions ?
c-Quels ions vont formes les atomes de a- ?
d-Donner la structure électronique de ces ions .
10)Exercices du livre : n°
s : 5,6,710,20 et 22 pages 195 et suivantes .
LES MOLECULES - CORRECTION :
1/En se formant , les molécules sont en général des entités plus stables que les atomes dont elles sont constitués .
2/Une liaison covalente est la mise en commun de deux éléctrons provenant de deux atomes différents .
3/Un doublet liant n'est autre qu'une liaison de covalence
4/ On parle de doublet non liant lorsque deux électrons d'une même couche d'un atome s'apparient sans participer à une liaison entre deux atomes .
5/Deux molécules sont isomères si elles ont la même formule brute et que leurs formules développées sont différentes .
6/Une formule brute ne fait apparaître que les atomes et leur nombre dont est constituée la molécule . Une formule développée fait apparaître en plus les différentes liaisons entre les atomes .
7/Une liaison covalente est constituée d'un doublet d'électrons provenant :
a-de la couche externe d'un atome - FAUX
b-de la couche interne d'un atome - FAUX
c-des couches externes de deux atomes . - VRAI
8)Une liaison covalente lie :
a-deux atomes - VRAI
b-plusieurs atomes - FAUX
c-deux ions . - FAUX
9)Stabilité chimique :
a-Hormis les atomes de la dernière colonne de la classification périodique (colonne VIII - gaz rares) , les atomes ne sont pas en général stables : c'est la raison pour laquelle ils ont tendance à s'associer entre eux pour former des molécules .
Ainsi les atomes ![]() ne sont pas stables
. Par contre l'atome
ne sont pas stables
. Par contre l'atome ![]() est stable
est stable
b-les atomes stables n'ont pas en général tendance à gagner ou perdre des électrons (puisqu'ils sont stables) : ils ne forme donc pas facilement des ions .
c-Un ion est en général stable lorsqu'il a une structure électronique de gaz rare .
* le phosphore (colonne VA) va avoir tendance à acquérir 3 électrons pour donner l'ion P3-: sa structure électronique sera alors celle de l'argon .
* L'oxygène (colonne VIA) va avoir tendance à acquérir 2 électrons pour donner l'ion O2- : sa structure électronique sera alors celle du néon .
* le magnésium (colonne IIA) va avoir tendance à perdre 2 électrons pour donner l'ion Mg2+ : sa structure électronique sera alors celle du néon .
d- P3- : (K)2(L)8(M)8 ; O2- : (K)2(L)8 ; Mg2+ : (K)2(L)8
Exercice 5 page 195 :
1/ Be : (K)2(L)2 : 2 électrons sur la couche externe .
P : (K)2(L)8(M)5 : 5 électrons sur sa couche externe .
S : (K)2(L)8(M)6 : 6 électrons sur sa couche externe .
2/ Be a tentance à donner Be2+ (structure électronique de l'hélium)
P a tendance à donne P3- (structure électronique due l'argon )
S a tendance à donne S2- : structure électronique de l'argon .
Exercice 6 page 195 :
1/F : (K)2(L)7 : 7 électrons externes
H : (K)1 : 1 électron externe .
2/F : il lui manque 1 électron pour avoir la structure électronique du néon et être stable (règle de l'octet). Cet atome doit donc établir 1 liaison de covalence pour être stable : nL(F)= 1 .
H : il lui manque 1 électron pour avoir la structure électronique de l'hélium et être stable (règle du duet) . Cet atome doit donc établir 1 liaison de covalence pour être stable : nL(H) =1
3/ Le nombre d'électrons externes de la molécule HF est égal à la somme des nombres d'électrons externes de chacun des atomes dont est constituée la molécule . Par conséquent nt= 7+1=8 électrons .
Le nombre de doublets externes correspondant est : nd = nt/2 = 4 .
4/Modèles de Lewis des atomes :
![]()
Modèle de Lewis de la molécule :
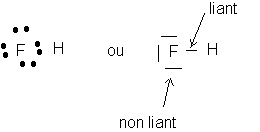
Seul le doublet liant H et F est liant . Les autres (trois) sont des doublets non liants .
Exercice 7 page 195 :
1/ Structures électroniques :
Cl (K)2(L)8(M)7 ; O : (K)2(L)6 ; H : (K)1
Le chlore a 7 électrons externes , l'oxygène 8 et l'hydrogène 1 .
2/Il manque 1 électron au chlore pour acquérir une structure en octet , 2 à l'oxygène et 1 à l'hydrogène pour acquérir une structure électronique en duet .
Le nombre de liaisons covalentes nécessaires est par conséquent : nL= 1+2+1 = 4 .
3/Le nombre total d'électrons externes de la molécule est : 7+6+1 = 14 électrons . Le nombre de doublets externes correspondants est nd = nl/2 = 7 .
4/Représentation de Lewis de la molécule :

Le chlore posséde 3 doublets non liants , l'oxygène 2 .
Exercice 10 page 196 :
1/ H : (K)1 : 1 électron externe ; O : (K)2(L)6 : 6 électrons externes .
2/Il manque 1 électron à l'hydrogène pour acquérir une structure en duet , 2 électrons à l'oxygène pour acquérir une structure électronique en octet .
Chaque atome d'hydrogène doit donc établir 1 liaison de covalence , chaque atome d'oxygène doit établir 2 liaisons de covalence .
3/ nL = 2*1 + 2* 6 = 14 électrons externes (2 atomes d'hydrogène et 2 atomes d'oxygène par molécule) . nd = nL/2 = 7
4/Représentation de Lewis de H2O2 :
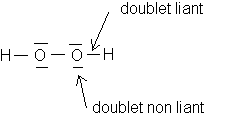
2 doublets non liants par atome d'oxygène .
Exercice 20 page 197 :
1/Deux molécules sont isomères si elles ont même formule brute et des formules développées (ou représentations de Lewis) différentes .
2/a : C : (K)2(L)4 ; H : (K)1 ; N : (K)2(L)5
Le nombre d'électrons externes de la molécule est nL = 3*4+9+5 = 26 électrons . Le nombre de doublets externes correspondants : nd = 13
On pourra vérifier par ailleurs qu'un atome de carbone C est tétravalent (4 liaisons de covalence sont nécessaires pour qu'il acquiert une structure électronique en octet) , l'atome d'hydrogène est monovalent (1 liaison de covalence est nécessaire pour qu'il acquiert une structure électronique en duet )
b:
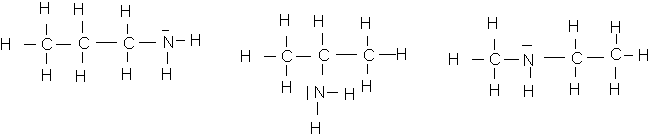
c: les formules semi-développées correspondantes sont :
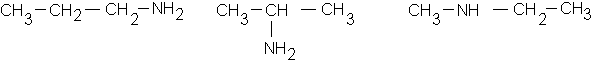 L
L
Exercice 22 page 198 :
1/ Les éléments présents dans la formule sont le carbone C (noir) , l'azone N (bleu) , l'oxygène O (rouge) et l'hydrogène H (blanc).
La formule brute de la molécule est CON2H4 . On y trouve des liaisons simples et une liaison double
2/Le nombre d'électrons externes de la molécule est :
4*1 (hydrogène) + 2*5 (azonte) + 1*6 (oxygène) +1*4 (carbone) = 24 . . Sur ces 24 électrons :
- 16 sont engagés dans des doublets liants .
- 8 constituent des doublets non liants (2 doublets pour l'atome d'oxyfgène et 1 doublet par atome d'azote)
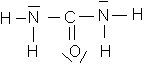
La représentation de Lewiw fait bien apparaître :
- 8 doublets liants
-4 doublets non liants
3/La molécule est constituée de 8 atomes :
*4 atomes de carbone , soit 50 %
* 1atome d'oxygène , soit 1/8= 0,125 = 12,5 %
*1 atome de carbone , soit 12,5 %
* 2 atomes d'azote soit 2/8= 0,25 = 25%