Chimie 2de TP5 : mole et concentration molaire
Références :
-chapitre
16 pages 246 à 261
-A
retenir : essentiel page 255
-chrono :page
256
-Exercice
résolu : page 258
-chapitre
6 pages 86 à 101
-A
retenir : essentiel page 95
-chrono :
page 96
-Exercice
résolu page 98
I/La mole , unité de quantité de matière
a)Notion de « paquet »
-une douzaine d’œufs : « paquet de 12 œufs »
-un millier de bonbons : « paquet » de 1000 bonbons
b)La mole :
-une mole d’atomes d’hydrogène : « paquet » de NA atomes d’hydrogène où NA=6,02.1O23 .
Q1)Quelle
est la masse d’un atome de carbone 12 ? On donne la masse du
nucléon mn=1,67.1O-27
kg .
Q2)Quelle
est la masse d’une mole d’atomes de carbone 12 ?
c)Masse molaire atomique
C’est la masse d’une mole d’atomes . Elle s’exprime en g.mol-1
La masse molaire est indiquée dans la classification périodique pour chaque élément.
Exemples :
Phosphore P : MP = 31 g.mol-1
Oxygène O : MO =16 g.mol-1
Cuivre Cu : Mcu = 63,5 g.mol-1
Remarque : le chiffre qui indique la masse molaire se confond souvent avec le nombre de nucléons de l’atome (quand nous avons des nombres avec des décimales , cela est lié à la proportion d’isotopes de l’élément existant dans la nature).
d)Masse molaire moléculaire :
C’est la masse d’une mole de molécules. Pour la calculer on fait la somme des masses molaires atomiques des atomes dont est constituée la molécule.
exemple : H2O : MH2O = 2xMH+MO = 2+16=18 g.mol-1
Q3)Calculer
la masse molaire moléculaire du sulfate de cuivre CuSO4
e)Quantité
de matière et masse :
![]() n :
quantité de matière en mol
n :
quantité de matière en mol
M : masse molaire en g.mol-1
m : masse en g
Q4)Quelle
est la quantité de cuivre dans une masse m=100 g de cuivre ? (MCu=63,5 g.mol-1)
Q5)Quel
est le nombre d’atomes de cuivre contenus dans 100 g de
cuivre ?
II/Liquides
et solutions :
a)Masse
volumique ρ :
![]() ρ :
masse volumique en g.L-1
(ou en kg.L-1)
ρ :
masse volumique en g.L-1
(ou en kg.L-1)
m : masse en g (ou en kg)
V : volume en L
Remarque : la masse volumique est la masse par unité de volume
b)Concentration molaire en soluté C
![]() C :
concentration molaire en soluté (mol/L)
C :
concentration molaire en soluté (mol/L)
n : quantité de matière de soluté introduite (en mol)
V : volume de la solution (L)
Q6)On
prépare 500 mL d’une solution sucrée à partir de
m= 15 g de fructose de masse
molaire M= 180 g.mol-1 . Quelle est la concentration molaire
de
cette solution ?
c)Préparation d’une solution
sucrée de saccharose :
Mode opératoire :
-déposer un papier filtre sur la balance
-faire le zéro de la balance
-peser 2 g de sucre (déposer le sucre sur le papier filtre en utilisant une spatule)
-verser le sucre dans une fiole jaugée de 100 mL
-ajouter un peu d’eau distillée dans la fiole jaugée
-agiter
-ajouter de l’eau distillée jusqu’au trait de jauge
- agiter à nouveau de façon à bien homogénéiser le mélange
Q7)Représenter une fiole jaugée et une spatule sur votre copie
d)Concentration massique Cm
![]() où
m est la
masse de soluté , V le volume de la solution
où
m est la
masse de soluté , V le volume de la solution
Q8)Quelle
est l’unité de Cm si on exprime m en mg et V en
L ?
Q9)Montrer
que Cm = C* M
Q10)Quelle
est la concentration massique Cm de
la solution de saccharose précédemment
préparée ?
Q11)Calculer la masse
molaire du saccharose de formule brute C12H22O11.
Q12)Quelle est la concentration molaire de la solution de saccharose précédemment préparée ?
III/Dilutions :
a)Solution
mère et solution fille

Cm : concentration massique de la solution fille
Cm,0 : concentration massique de la solution mère
V : volume de la solution fille
V0 : volume de la solution mère
Quand on dilue , on ne modifie pas la masse de soluté introduite : m= Cm,0 * V0 = Cm*V et donc :
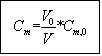
b)Facteur de dilution F :
![]() et donc
et donc ![]()
c)Préparation
d’une solution fille de diiode I2

Q13)On dispose d’une solution mère de diiode de concentration massique C m,0 = 2.10-2 g/L. Quel volume de la solution mère doit-on prélever pour préparer un volume V=100 mL de la solution fille de concentration Cm=4.10-3 g/L ?
Q14)Préparer
la solution et
décrire le mode opératoire en nommant notamment clairement la
verrerie
utilisée.
Q15)Quel est le
facteur de
dilution de la solution préparée ?
IV/Exercices :
-page 256 et suiv : 3,5,7,9,12,13,15,25 et 27
-page 96 et suiv :6,12,15,17,18,22,25 et 30
Chimie TP5 - correction - Mole et concentration molaire
1)Atome de carbone 12 :matome= A* mn ( A est le nombre de nucléons et mn la masse d’un nucléon - on peut admettre que la masse d’un neutron est pratiquement égale à celle d’un neutron ).
matome =12*1,67.10-27 = 2.10-26 kg
2)La masse d’une mole d’atomes est m=matome* NA = 2.10-26*6,2.1023=1,2.10-2 kg = 12 g
3)MCuSo4= MCu + MS + 4*M0 = 63,5+32+4*16= 159,5 g.mol-1 . (les masses molaires atomiques figurent dans les tableaux de la classification périodique).
4)n=m/M=100/63,5= 1,57 mol
5)Le nombre d’atomes correspondant est N = n*NA = 1,57*6,02.1023 = 9,4.1023 atomes
6)La quantité de matière de fructose introduite est : n=m/M = 15/180 = 0,083 mol . La concentration correspondante est C = n/V= 0,083/0,5 = 0,16 mol.L-1 .
7) fiole jaugée :
spatule :
![]()
8) Cm = m/V s’exprime en mg/L lorsque m est exprimé en mg et V en L
9) Cm = m/V et n = m/M . La seconde formule conduit à m = n*M . En combinant les deux formules , cela donne :
![]()
10)Pour la solution de saccharose précédemment préparée : Cm = m/V = 2/0,1 = 20 g.L-1 .
11)Masse molaire moléculaire du saccharose C12H22O11: M=12 MC+ 22 MH + 11 MO = 12*12+22+11*16=342 g.mol-1 .
12) C = Cm/M = 20/342= 5,8.10-2 mol.L-1 .
13)Cm*V = Cm,0*V0
. Le
volume à prélever est V0=![]()
14)On prélève 20 mL de la solution mère avec une pipette jaugée de 20 mL dont on verse le contenu dans une fiole jaugée de 100 mL . Avec une pissette d’eau distillée on peut rincer la pipette jaugée et récupérer l’eau de rinçage dans la fiole jaugée.
On ajoute un peu d’eau distillée dans la fiole jaugée , puis on agite . On complète alors avec de l’eau distillée jusqu’au trait de jauge de la fiole jaugée puis on agite à nouveau afin de bien homogénéiser la solution fille obtenue .
15)Le facteur de dilution F est F= Cm,0/Cm = 2.10-2/4.10-3 =5