Chimie TP 4 :Quelques réactions chimiques
Références :
-chapitre
17 pages 262 à 277
-A
retenir : essentiel page 271
-chrono :page
272
-Exercice
résolu : page 274
I/Combustion du carbone dans le dioxygène :
a)Expérience : Port des lunettes obligatoire
*
Porter un morceau de fusain (carbone C )à incandescence grâce
à un bec bunsen
(image ci-dessous)
*L’introduire
dans un flacon de dioxygène O2(image suivante)


Q1)Que se passe
t-il lorsqu’on
introduit le fusain incandescent dans le flacon contenant du
dioxygène ?
Q2)Qu’observe
t-on dans le flacon
après la réalisation du test à l’eau de
chaux ?
b)La
transformation chimique :
Nous
avons réalisé une transformation chimique :
*
le carbone C et le dioxyène sont les réactifs
*Le dioxyde de carbone CO2 est le produit . Celui-ci
est mis
en évidence par l’eau de chaux qui se trouble en
présence de dioxyde de
carbone.
c)La réaction
chimique
Elle modélise
la transformation chimique
C + O2
---->
CO2
traduction à l’échelle microscopique : un atome de carbone réagit avec une molécule de dioxygène O2 pour donner une molécule de dioxyde de carbone CO2 .
*à gauche , nous avons les réactifs
* à droite , nous avons les produits
Q3)Combien
y a t-il d’atomes de carbone parmi les réactifs ?parmi
les produits ?
Q4)Combien
y a t-il d’atomes d’oxygène parmi les
réactifs ? parmi les produits ?
Nous retiendrons : Dans une
transformation
chimique , les éléments se conservent
d)Formules
développées
Nous allons écrire la réaction en utilisant les formules développées :

Q5)Donnez
les structures électronique du carbone et de l’oxygène
(utiliser la
classification périodique)
e)Modèle de Lewis
Le modèle de Lewis d’un élément chimique consiste à représenter l’élément en faisant apparaître sa dernière couche électronique . Les électrons sont représentés par des points ;
Exemple : le carbone 
Q6)Représenter
le modèle de Lewis de l’oxygène
On généralise le modèle de Lewis aux molécules
Exemple : le dioxygène O2 :

Dans la seconde représentation , chaque trait correspond à un doublet .
Tout se passe pour les atomes d’oxygène comme s’ils se prêtaient des électrons : chaque atome d’oxygène « prête » deux électrons à l’autre . Chaque atome d’oxygène satisfait ainsi à la règle de l’octet ce qui est un signe de stabilité (la molécule O2 est stable alors qu’un atome d’oxygène seul ne l’est pas).
Q7)Représenter
le modèle de Lewis de CO2 .
Q8)Dans ces molécules quel est le nombre de liaisons
engagées par le
carbone, l’oxygène ? (voir TP2 chimie)
II/Etude
de quelques réactions de précipitation.
Dans différents tubes à essai on verse environ 2 mL ( » 2 cm dans le tube) d’une solution ionique aqueuse puis on ajoute quelques gouttes d’une solution de soude aussi appelée solution d’hydroxyde de sodium NaOH.
Q9)Recopiez
sur votre copie et complétez le tableau
suivant :
| N° | Solution ionique dans le tube à essai | Formule chimique | Forme ionique | Formule ionique de la soude | Observations après ajout de la soude | Formule brute du produit obtenu |
| 1 | Sulfate de cuivre | | | | | |
| 2 | Sulfate de fer (II) | | | | | |
| 3 | Chlorure de fer (III) | | | | | |
| 4 | Sulfate de Zinc | | | | | |
Dans les 4 réactions chimiques observées, les ions sodium Na+ de la soude sont dits «spectateurs», c’est à dire qu’ils ne participent pas à la réaction. Il en est de même des ions sulfate SO42- et des ions chlorure Cl- .
Dans une réaction de précipitation, le produit obtenu est toujours issu de la réaction entre un cation et un anion.
Q10)En
déduire, les quatre équations des transformations chimiques
étudiées. On
ajustera celle-ci en respectant
la conservation des éléments ainsi que la charge
électrique.
Préciser
dans chaque cas , quels sont les réactifs et quels sont les
produits.
Q11)Quels
sont les noms des précipités que l’on a
obtenu ?
III/Réaction avec le métal cuivre
a)Expérience :
- Introduire un morceau de copeau de cuivre Cu dans un tube à essai
- Verser environ 1 mL d’une solution de nitrate d’argentAgNO3 ( Ag+,NO3-)
-NE PAS AGITER , laisser reposer une à deux minutes.
Q12)Faire
un schéma légendé de l’expérience.
Q13)Sachant que les ions nitrates NO3-
sont spectateurs, quels sont les réactifs ?
b)Résultat de
l’expérience :
agiter le tube à essai, laisser décanter la solution et observer la couleur de la solution.
Q14)Quelle
est la couleur de la solution obtenue ?
La couleur de la solution obtenue est due à la présence d’ions Cu2+ en milieu aqueux.
Q15)Ecrire
l’équation de la réaction
IV/Effet
thermique d’une
réaction chimique :
L’expérience est réalisée par le professeur : elle consiste à mélanger de l’acide chlorhydrique et de la soude et on mesure la température .
Q16)Faire
le schéma de l’expérience.
Q17)Que
peut-on dire de la température ?Comment
peut-on interpréter son évolution ?
I/Exercices :
Lire l’activité expérimentale 2 page 265
Page 272 : n°s : 5 , 6 , 8 ,9 et 15
Travailler l’exercice résolu page 274
TP4 Chimie 2de
-
Correction
1)Lorsqu’on introduit le fusain au préalable rougi avec la flamme du bec bunsen , l’incandescence du morceau de fusain s’intensifie .
2)L’eau de chaux se trouble : nous mettons ainsi en évidence la formation de CO2 (dioxyde de carbone) lorsque le fusain (carbone) réagit avec le dioxygène.
3)Il y a un atome de carbone parmi les réactifs et également un parmi les produits.
4)Il y a deux atome d’oxygène parmi les réactifs et également deux parmi les produits (la molécule de dioxygène O2 contient deux atomes d’oxygène, et la molécule de dioxyde de carbone contient également deux atomes d’oxygène).
Remarque : on dit que l’équation de la transformation chimique est équilibrée (autant d’éléments de chaque espèce d’un coté que de l’autre)
5)Structures électroniques :
Carbone C : (K)2(L)4 [deuxième période , colonne IV]
Oxygène O : (K)2(L)6 [deuxième période , colonne VI ]
6)Modèle de Lewis de l’oxygène :

7)Modèle de Lewis de CO2 :
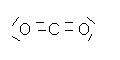
8)Le carbone engage 4 liaisons dans la molécule de CO2 , ce qui lui permet d’acquérir une structure de gaz rare (8 électrons sur la dernière couche en considérant que les atomes engagés dans les liaisons se « prêtent » mutuellement des électrons.
Chaque atome d’oxygène engage 2 liaisons , que ce soit dans O2 ou dans CO2 .Chaque atome d’oxygène acquiert ainsi une structure électronique de gaz rare.
O2 et CO2 sont des molécules stables .
9)
| N° | Solution ionique dans le tube à essai | Formule chimique | Forme ionique | Formule ionique de la soude | Observations après ajout de la soude | Formule brute du produit obtenu |
| 1 | Sulfate de cuivre | CuSO4 | Cu2+/SO42- | Na+/HO- | Précipité bleu-vert | Cu(OH)2 |
| 2 | Sulfate de fer (II) | FeSO4 | Fe2+/SO42- | | Précipité verdâtre | Fe(OH)2 |
| 3 | Chlorure de fer (III) | FeCl3 | Fe3+/3Cl- | | Précipité brun | Fe(OH)3 |
| 4 | Sulfate de Zinc | ZnSO4 | Zn2+/SO42- | | Précipité blanc | Zn(OH)2 |
10)Les espèces inertes ne sont pas représentées dans les équations .
Cu2+ + 2HO- à Cu(OH)2 : Cu2+ et HO- sont les réactifs , Cu(OH)2 le produit
Fe2+ + 2HO- à Fe(OH)2 : Fe2+ et HO- sont les réactifs , Fe(OH)2 le produit
Fe3+ + 3HO- à Fe(OH)3 : Fe3+ et HO- sont les réactifs , Fe(OH)3 le produit
Zn2+ + 2HO- à Zn(OH)2 : Zn2+ et HO- sont les réactifs , Zn(OH)2 le produit
Toutes ces équations satisfont à :
-la conservation des éléments
-la conservation de la charge électrique
11) Noms des précipités :
Cu(OH)2 : hydroxyde de cuivre II
Fe(OH)2 : hydroxyde de fer II
Fe(OH)3 :hydroxyde de fer III
Zn(OH)2 : hydroxyde de zinc
12)
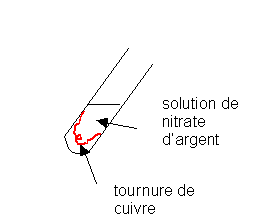
Le cuivre noircit puis se recouvre de petits cristaux brillants d’argent .
13) Les réactifs sont le cuivre et les ions Ag+ .
14) La solution devient bleue.
15)Equation de la réaction :
Cu + 2Ag+ à Cu2+ + 2Ag
16)

La température de la solution augmente lorsqu’on mélange l’acide chlorhydrique et la soude . La réaction entre l’acide chlorhydrique et la soude produit de la chaleur : on dit que la réaction est exothermique .
Ecriture de la réaction : H3O+ + HO- à 2H2O
![]()