REACTION CHIMIQUE - BILAN DE MATIERE
I/Transformation chimique et réaction chimique :
a)Transformation chimique :
Une transformation chimique est un phénomène qui conduit un système chimique d'un état initial à un état final .
b)Réaction chimique :
Un réaction chimique est un modèle qui rend compte à l'échelle macroscopique de la transformation chimique ( ex 2H2 + O2 ---> 2H2O )
II/Avancement d'une réaction chimique :
a)Tableau d'avancement :
Exemple : la synthèse de l'eau :
Equation de la réaction |
2H2 + O2 ------------> 2H2O |
||
Etat initial (X = 0) |
1 |
2 |
0 |
Etat intermédiaire : X |
1-2X |
2-X |
2X |
Etat final : Xmax |
0 |
1,5 |
1 |
* Etat initial : correspond aux quantités (en mol) de réactifs mélangés : ici on mélange 1 mole de H2 et 2 mol de O2 .
* Etat intermédiaire : Une transformation chimique n'est pas en général instantanée : au cours du temps les quantités de produits et de réactifs varient avant de parvenir à l'état final . On définit une grandeur notée "X" qu'on appelle "Avancement de la réaction" : l'unité de cette grandeur est la mol Cette grandeur "rend compte" de l'évolution des quantités de réactifs et de produits au cours de l'évolution de la transformation chimique .
1-2X signifie : lorsque l'avancement de la réaction est égal à X , il reste 1-2X mol de H2 qui n'ont pas réagi .
2 X signifie : lorsque l'avancement est égal à X , 2X moles d'eau se sont formées .
* Etat final : L'un des réactifs a complètement disparu : la réaction ne se "produit" plus .L'avancement est alors maximal et on le note Xmax .
b)Avancement maximal , réactif limitant :
L'objectif est de déterminer quel réactif a complètement disparu lorsque la transformation chimique est terminée : Ce réactif est appelé "réactif limitant" (l'autre réactif est dit en excès).
On résoud les 2 équations :
1-2X=0 ce qui donne X= 0,5 mol
2-X= 0 ce qui donne X=2 mol
On retient la plus petite des deux valeurs trouvées : c'est l'avancement maximal . Xmax= 0,5 mol .
Nous pouvons alors compléter la dernière ligne du tableau en à partir de l'avant-dernière en remplaçant X par Xmax=0,5 mol
c)Lecture du tableau à l'état final :
La dernière ligne du tableau se lit de la façon suivante :
Lorsque la transformation chimique est terminée , tout le dihydrogène a réagi , 1,5 mol d'eau se sont formées et il reste 1,5 mol de dioxygène qui n'a pas réagi .
d)Bilan de la transformation chimique :
ETAT initial : 2 mol de O2 et 1 mole de H2
ETAT final : 1,5 mol de O2 , 1 mol de H2O
e)Cas particulier : les réactifs sont dans les proportions stoechiométriques :
Dans ce cas , il ne reste plus de réactifs à l'état final (voir TP)
f)Remarque :
Lors d'une transformation chimique , l'un des réactifs ne disparaît pas toujours complètement . On alors que la transformation est limitée ou qu'elle n'est pas totale .
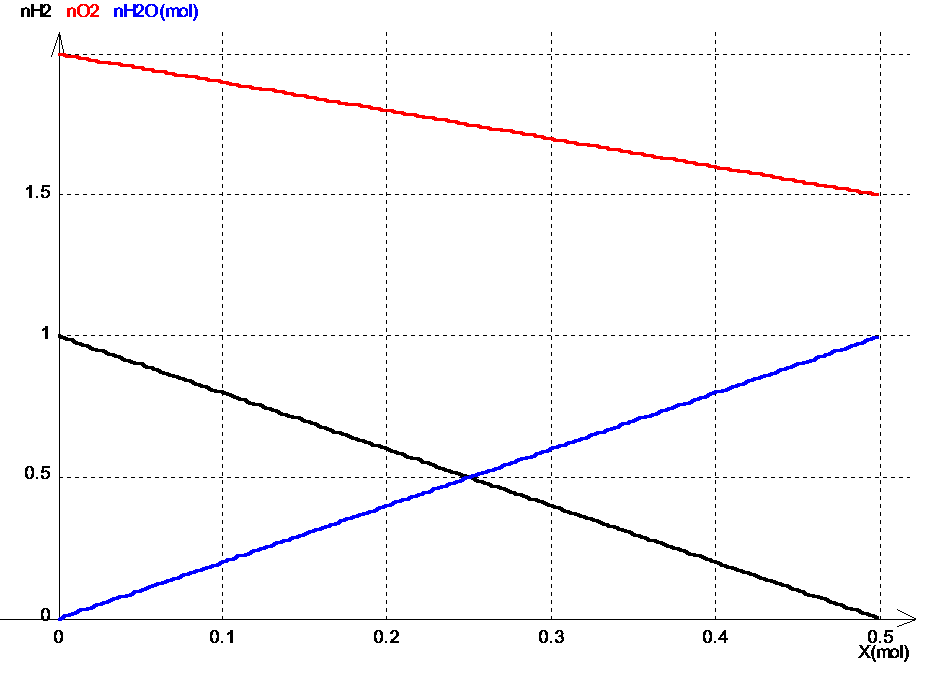
III/Interprétation graphique
a)Construction du graphique :
Nous reprenons le cas de la synthèse de l'eau envisagé plus haut .
Nous traçons les droites , lorsque X varie entre 0 et Xmax = 0,5 mol .
nH2=1-2X ou quantité de H2 en fonction de X
nO2 = 2-X ou quantité de O2 en fonction de X
nH2O = 2X ou quantité de H2O en fonction de X

b)Utilisation du graphique :
On peut lire sur le graphique :
* Quand X=0 (état initial) : nH2 = 1 mol ; nO2=2 mol ; nH2O= 0 mol
* Quand X=Xmax=0,5 mol : nH2 = 0 mol ; nO2 = 1,5 mol ; nH2O= 1 mol .