LES MOLECULES - Cours 2de
I/Gaz rares ou nobles :
Ce sont les éléments de la dernière colonne de la classification périodique :
* ils sont stables
* ils ont 2 (hélium) ou 8 électrons sur leur dernière couche .
II/Formation des molécules :
a)Représentation de Lewis d'un atome :
La représentation de Lewis d'un atme fait apparaître la dernière couche électronique de l'atome.
exemple : Cl (7 électrons sur la dernière couche)

b)liaison de covalence :
Deux atomes forment une liaison de covalence en mettant en commun un doublet d'électrons

c)Règles du duet et de l'octet :
* Règle du duet :les atomes dont le numéro atomique est proche de celui de l'hélium ont tendance à acquérir la même structure électronique externe (K)
2 .exemple : Z=3 Li : (K)
2(L)1 en perdant 1 électron acquiert la structure électronique du néonLi
+ : (K)2 est stable*Règle de l'octet : les autres atomes ont tendance à acquérir la même structure électronique que le gaz rare le plus proche .
exemple : Z= 9 F :(K)
2(L)7 en gagnant un électron acquiert la structure électronique du néon :(K)2(L)8 : l'ion F- est stable .d)Représentation de Lewis des molécules :
* Les doublets non liants sont les paires d'électrons qui ne servent pas de liaisons entre deux atomes
* Dans la représentation de Lewis, la règle du "duet" doit être satisfaite pour chaque atome d'hydrogène et la règle de "l'octet" doit être satisfaite pour tous les autres atomes.
exemple : H
2O
e)Méthode permettant d'établir la représentation de Lewis d'une molécule.
1-Déterminer le nombre d'électrons périphériques apportés par chaque atome de la molécule.
2-Déterminer le nombre total n d'électrons périphériques de la molécule.
3-En déduire le nombre de doublets (liants et non liants) à répartir dans la molécule. Pour cela il suffit de diviser n par 2.
4-Déterminer le nombre de liaisons qu'établit chaque atomes de la molécule . Cette opération donne le nombre de doublets liants.
5-En déduire le nombre de doublets non liants et les répartir autour des atomes
en respectant la règle de l'octet (ou du duet)Exemple
: on veut représenter le modèle de Lewis de la molécule de chlorure d'hydrogène HCl. (H: Z=1; Cl: Z=17.)1-H: 1 électron périphérique. Cl: 7 électrons périphériques.
2-n=1+7 ou n=8
3-Le nombre de doublets est alors 4
4-H établit 1 liaison covalente et Cl établit 1 liaison covalente. Ce qui correspond à un doublet liant mis en commun entre ces deux atomes.
5-Il reste donc 3 doublets non liants qui seront répartis autour de l'atome de chlore de façon à respecter la règle de l'octet. Le respect de la règle du duet est assuré pour l'atome 'hydrogène par la présence du doublet liant.
![]()
f)Doubles et triples liaisons :
Deux atomes peuvent être reliés par deux doublets liants et même trois doublets .
Exemples :
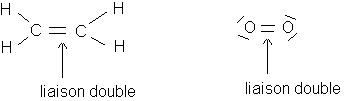
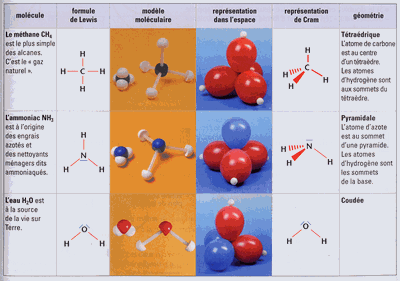
1/Disposition spatiale des doublets.
La théorie de la répulsion minimale des doublets permet de rendre compte de la géométrie des molécules.
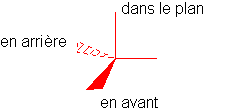
2/Représentation de Cram :
*Les liaisons situées dans le plan de la feuille sont dessinées en traits pleins.
*Les liaisons situées en avant du plan de la feuille sont dessinées en traits épaissis.
*Les liaisons en arrière du plan de la feuille sont dessinées en pointillés.
3)Exemples de molécules :
IV/Isomères :
Il peut arriver que deux corps purs aient même formule brute et que leurs molécules soient différentes : ce sont des isomères .
Exemple :
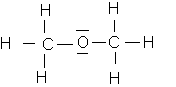
Ethanol : formule brute C
2H6Ométhoxyméthane : formule brute C
2H6Oformule de Lewis de l'éthanol :

formule de Lewis du méthoxyméthane :