TP C7 : Simulation d'une réaction acido-basique de dosage
I/Objectif :
Il s'agit de simuler la réaction acide-base qui a été réalisée expérimentalement pendant le TP précédent (TP C6) , en visualisant :
* l'évolution du pH
* l'évolution des différentes quantités de matière (réactifs et produits)
II/Avancement maximal d'une réaction :
On considère la réaction suivante :
3 I2 + 6 OH- ---------> 5I- + IO3- + 3H2O
Les réactifs sont mélangés dans différentes proportions qui sont indiquées dans le tableau ci-dessous (les quantités de matière sont exprimées en mmol ):
I2 |
OH- |
Réaactif en défaut |
Avancement maximal |
Qté et nom du réactif restant |
2 |
1 |
|||
2 |
2 |
|||
2 |
3 |
|||
2 |
4 |
|||
2 |
5 |
|||
2 |
6 |
|||
2 |
7 |
|||
2 |
8 |
|||
2 |
9 |
|||
2 |
10 |
Q1)Recopiez le tableau sur votre copie et complétez le .
Q2)Des différents mélanges de réactifs proposés , quelle est la valeur maximale de l'avancement maximal ?
Q3)Construire la courbe qui représente l'évolution de l'avancement maximal en fonction de la quantité d'ions OH- introduite au départ ? Mettre en évidence la valeur maximale de l'avancement maximal . Qu'observez vous ?
III/Simulation :
Le logiciel utilisé (Simul_A_B) fonctionne sous Excel . On lance le logiciel par un double-click sur l'icône correspondante qui se trouve dans le répertoire Microsoft .
a)L'objet de la simulation :
On verse dans un bécher 20 mL d'une solution d'acide éthanoïque décimolaire . Une burette contient 30 mL de soude décimolaire , que l'on verse progressivement dans le bécher .
b)Le fonctionnement du logiciel :
le logiciel permet de :
* visualiser sous forme d'histogramme l'évolution des réactifs et et de l'ion éthanoate (courbe de gauche) .
Si on souhaite ne visualiser que cette courbe , cliquer sur ![]()
* visualiser l'évolution du pH en fonction du volume de soude versé (courbe de droite).
Pour visualiser cette courbe et la précédente cliquer sur ![]()
*visualiser l'évolution des différentes quantité de matière (réactifs et produit) en fonction du volume de base versé .
La simulation du dosage étant terminée , un click sur "Voir l'Avancement maximal " permet de montrer deux courbes :
* l'évolution de l'avancement maximal en fonction du volume de base versé (courbe de gauche)
* l'évolution des quantités de matière en fonction de l'avancement maximal .
La rapidité de la simulation peut être réglée en actionnant le
curseur situé en haut à droite de l'écran :![]() . Les valeurs
limites sont 1000 (rapide) et 1 (lent) .
. Les valeurs
limites sont 1000 (rapide) et 1 (lent) .
Il est possible , en cours de simulation de stoper la simulation cliquant sur le bouton "Arrêter" situé en haut à droite de l'écran . Un nouveau click sur le même bouton (dont l'intitulé est alors "RELANCER") permet de poursuivre la simulation .
c)Démarrage de la simulation :
* cliquer sur "Remplir la burette" (Il est fort possible que la souris soit alors inactive pendant quelques instants: laisser à Excel le temps d'effectuer les calculs nécessaires à la simulation ).
*Régler la "vitesse"
* cliquer sur "Titrage automatique"
IV/Evolution du pH
Q4) Ecriver l'équation-bilan de la réaction entre l'acide éthanoïque et les ions OH- .
Q5)Rappelez la définition du pH .
Q6)Rappelez la définition de l'équivalence .
Q7)Qu'est-ce qu'une réaction totale ?
Q8)Calculer la quantité d'acide contenu dans 20 mL de la solution décimolaire d'acide éthanoïque .Quelle quantité de soude faut-il verser pour atteindre l'équivalence ? A quel volume de solution cela correspond -il avec une solution de soude décimolaire ?
Q9)Observez l'évolution de l'histogramme : Expliquez pourquoi la quantité d'ions OH- dans le milieu réactionnel est nulle jusqu'à l'équivalence bien que l'on verse des ions OH- dans le milieu réactionnel . La réaction entre l'acide éthanoïque et les ions OH- est-elle totale ?
Q10)Que deviennent les ions OH-dans le milieu réactionnel après l'équivalence .
Dans une solution aqueuse le produit [H3O+}[OH-] = Ke est constant (Ke est appelé produit ionique de l'eau et Ke = 10-14 à 25°C) .
Q11)Quelle est la valeur du pH pour vb = 15 mL .Calculer alors les valeurs des concentrations [H3O+] et [OH-]. Refaire les mêmes calculs au point d'équivalence E .
Q12)Quelle est la valeur du pH pour vb = 25 mL ? Calculer :
1- les valeurs de [H3O+] et [OH-] correspondantes .
2- le volume de la solution
3- la quantité d'ions OH- présents dans le milieu réactionnel
Comparer cette quantité à la quantité d'ions OH- contenue dans 5 ml de soude décimolaire , ce qui correspond au volume de soude ajouté après l'équivalence .Conclure
Q13)Comment varie la quantité d'ions éthanoate après l'équivalence ? Justifiez .Comparer à la quantité initiale d'acide introduit dans le bécher .Conclure .
Q14)Quelle fonctionnalité du logiciel vous permet de retrouver certaines valeurs parmi celles calculées précedemment ? Faites les vérifications .
V/Avancement maximal :
Faites apparaître à l'écran l'état de l'avancement maximal au cours du titrage .
Q15)Recopiez les deux courbes sur votre copie .
Q16)Faites le rapprochement entre la courbe qui représente l'avancement maximal en fonction du volume de base versé et la courbe tracée à la question Q3. Quelles sont vos observations ?
Q17)Comment expliquer le comportement particulier de la courbe qui représente la quantité d'ions OH- en fonction de l'avancement maximal à Xm = 2 10-3 mol ?
VI/Exercice complémentaire :
Q18)On met 20 mL de soude dans le bécher et 30 mL d'acide éthanoïque dans la burette .Représentez les courbes :
* n(CH3COOH) = f1 (V)
* n(CH3COO-) = f2 (V)
* n(OH-) = f3(V)
* Xm= f4(V)
Correction :
Q1)Le tableau d'avancement relatif à la première ligne est représenté ci-dessous :
Equation chimique |
3I2 + 6OH- -----------> 5I- + IO3- | ||||
Etat du système |
Avancement (mol) |
Quantités de matière |
|||
Etat initial |
0 |
2 |
1 |
0 |
0 |
En cours de trans. |
X |
2-3X |
1-6X |
5X |
X |
Etat final |
Xm=1/6 mmol |
1,5 |
0 |
5/6 |
1/6 |
Suivant le même principe , nous pouvons remplir les différentes lignes du tableau
I2 |
OH- |
Réaactif en défaut |
Avancement maximal |
Qté et nom du réactif restant |
2 |
1 |
OH- |
1/6 |
I2 reste 1,5 mmol |
2 |
OH- |
1/3 |
I2 - 1 mmol |
|
2 |
3 |
OH- |
0,5 |
I2 - 0,5 mmol |
2 |
4 |
OH- |
2/3 |
aucun |
2 |
5 |
I2 |
2/3 |
OH- - 1 mmol |
2 |
6 |
I2 |
2/3 |
OH- - 2 mmol |
2 |
7 |
I2 |
2/3 |
OH- - 3 mmol |
2 |
8 |
I2 |
2/3 |
OH- - 4 mmol |
2 |
9 |
I2 |
2/3 |
OH- - 5 mmol |
2 |
10 |
I2 |
2/3 |
OH- - 6 mmol |
Q2)La valeur maximale de l'avancement maximal est (Xm)max = 2/3 mmol
Q3)
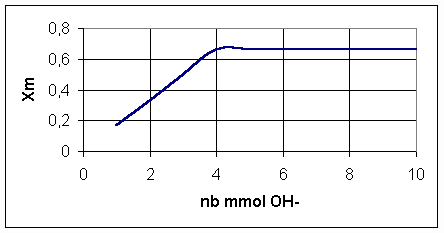
L'avancement maximal est (Xm)max = 2/3 . L'avancement est maximal une fois que les réactifs ont été mélangés dans les proportions stoechiométriques (équivalence), c'est à dire à partir de n(OH-)= 4 mmol.
Q4)CH3COOH + OH- ------> CH3COO- + H2O
Q5)pH = - log [H3O+] ou [H3O+] = 10-pH .
Q6)L'équivalence est atteinte lorsque les réactifs ont été mélangés dans les proportions stoechiométriques de l'équation-bilan .
Q7)Une réaction est totale lorsque le réactif limitant disparaît complètement .
Q8)na = CaVa = 0,1*20 10-3 = 2 10-3 mol = 2 mmol.
La réaction se faisant mole à mole , pour atteindre l'équivalence, il faut verser nb=2 mmol de soude . Le volume correspondant est Vb= nb/Cb = 20 mL .
Q9)L'histogramme permet de faire plusieurs observations au cours de la réaction :
* La quantité d'ions OH- dans le milieu réactionnel reste nulle jusqu'à l'équivalence .
* il se forme autant d'ions éthanoate CH3COO- qu'ont réagi de molécules d'acide éthanoïque .
La quantité d'ions OH- reste nulle jusqu'à l'équivalence , car les ions OH- réagissent immédiatement avec l'acide éthanoïque . Cette réaction est bien totale , car tant que les ions OH- sont en défaut ils disparaissent totalement en réagissant avec l'acide éthanoïque .
Q10)Après l'équivalence , les ions OH- apportés ne réagissent plus (il n'y a plus d'acide éthanoïque) et ils restent par conséquent dans la solution (ils ont le comportement d'une espèce inerte).
Q11)*Pour Vb=15 mL , pH= 5,27 . [H3O+] = 10-5,27 = 5,3 10-6 mol.L-1 . [OH- ] = 10-14/5,3 10-6 = 1,86 10-9 moL.L-1 .
* Pour Vb=20 ml pH=8,75 ; [H3O+] = 10-8,75 = 1,8 10-9 mol.L-1 . [OH- ] = 10-14/1,8 10-9 = 5,62 10-6 moL.L-1 .
Q12)Pour Vb=25 mL pH= 12,05 et donc
1-[H3O+]= 10-12,05 =8,91 10-13 mol.L-1 et [OH-]= 11,22 10-3 mol.L-1 .
2- Vsolution = 45 mL
3- n(OH-) = [OH-]* Vsolution = 5 10-4 mol
5 mL d'une solution de soude décimolaire contiennent 5 10-3 * 0,1 = 5 10-4 mol d'ions OH- . Les deux quantités précédentes sont donc égales .
Q13)Après l'équivalence , la quantité d'ions éthanoates reste constante et égale à 2 mmol . Après l'équivalence , il n'y a plus d'acide éthanoïque et ce dernier ne peut donc plus réagir avec les ions OH- pour produire des ions éthanoate .
Cela correspond à la quantité d'acide éthanoïque initialement présente dans le bécher . Or d'après l'équation-bilan si 1 mol d'acide disparaît , alors 1 mole d'ions éthanoate est produite .....
Q14)Sur les courbes tracées par le logiciel , on peut notamment retrouver :
* n(CH3COO-) = 2 mmol une fois l'équivalence atteinte
* n(CH3COOH) = 0 à Vb=20 ml
*n(OH-) = 1 10-3 mol en fin de dosage .
* valeur maximale de l'avancement maximal égale à 2 mmol.
etc ........
Q15)

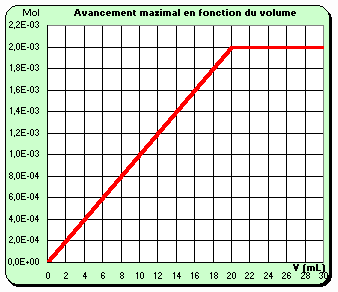
Q16)Le volume de soude versé est proportionnel à la quantité d'ions OH- . Les grandeurs relatives à l'axe des abscisses sont donc proportionnelles .L'une comme l'autre de ces deux courbes mettent bien en évidence la valeur maximale de l'avancement maximal une fois que l'équivalence est atteinte
Q17)Une fois l'équivalence atteinte , l'avancement maximal reste constant . Si on continue à verser des ions OH- après l'équivalence , la quantité d'ions OH- dans le milieu réactionnel augmente à Xm constant . D'où l'allure particulière de n(OH-) à Xm = (Xm)max =2 10-3 mol : demi-droite verticale .
Q18)

La courbe Xm = f4(V) est la même que précedemment .