TP C6 : SUIVI D'UNE REACTION ACIDO-BASIQUE
I/Préparation d'une solution titrée de soude :
Q1)Décrire le mode opératoire pour préparer 1 litre d'une solution décimolaire ( CB= 10-1 mol.L-1) d'hydroxyde de sodium (Na : 23 g.mol-1; O : 16 g.mol-1 ; H : 1 g.mol- 1).
II/Le pH ou mesure du caractère acide ou basique d'une solution :
a)Définition du pH
pH = - log[H3O+] ou [H3O+] = 10-pH pH ![]() [0,14]
[0,14]
Q2)Repérer la touche log dur la calculette . Calculer log 1 ; log 0,1 ; log (0,01)
b)Mesure :
* indicateurs colorés (notamment hélianthine , bleu de bromothymol ou BBT , phtaléine)
* le papier pH
* le pH-mètre
c)Utilisation du pH-mètre :
L'utilisation du pH -mètre nécessite un étalonnage préalable . On respectera l'ordre des étapes suivantes :
* Mettre le pH-mètre en route
* Rincer l'électrode en projetant à l'aide de la pissette un jet d'eau distillée à la partie inférieure de l'électrode (ne pas toucher avec les doigts) .
Si nécessaire , utiliser un morceau de papier filtre pour essuyer l'électrode .
* Plonger l'électrode dans une solution tampon de pH déterminé et
dont on connait la température . Appuyer sur la touche "Mesure" et régler la
température en utilisant les touches haut ![]() et
bas
et
bas ![]()
* Appuyer sur la touche "Etalon." et régler le pH à la valeur du pH de la solution tampon en utilisant les touches haut et bas .
* Appuyer sur la touche "Mesure" . L'appareil est alors réglé et on peut effectuer les mesures . On prendra soin de chaque fois rincer l'électrode entre deux mesures
Q3)Mesurer le pH
* d'une solution décimolaire d'acide chlorhydrique
* d'une solution décimolaire d'acide éthanoïque
* d'une solution centimolaire de soude .
De ces trois solutions , pour chacune d'entre ellles , dire si elle est acide ou basique .
III/Réaction entre une solution d'acide éthanoïque et de soude :
a)Mode opératoire

b)Mesures
V b (mL) |
0 |
1 |
3 |
5 |
10 |
15 |
18 |
18,5 |
19 |
19,5 |
20 |
20,5 |
21 |
21,5 |
pH |
22 |
24 |
26 |
30 |
35 |
40 |
Q4)Notez la teinte de la solution au départ suite à l'ajout de l'indicateur coloré .
Q5)Effectuer les mesures et remplissez sur votre copie un tableau identique à celui présenté ci-dessus .Au cours des mesures , noter :
* les valeurs de V
b et de pH lorsque l'indicateur coloré change de teinte .* la couleur finale prise par l'indicateur coloré .
c)Tracé (sur papier millimétré) de la courbe pH = f(V
b)
Q6)Tracez la courbe ph= f(V
b)IV/Interprétation et exploitation :
a)Couples acide/base :
Q7)Justifiez le caractère acide de l'acide éthanoÏque . Quelle est sa base conjuguée ?
Q8)Justifiez le caractère basique de l'ion OH- . Quelle est son acide conjugué ?
Q9)Ecrivez la réaction acide/base entre l'acide éthanoïque et les ions OH- de la solution d'hydroxyde de sodium (les ions Na+ sont inertes).
b) Equivalence :
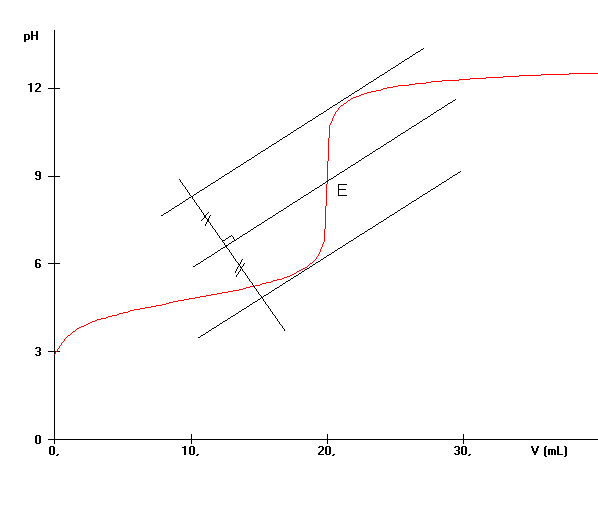
L'équivalence est atteinte lorsque les réactifs ont été mélangés dans les proportions stoechiométriques de l'équation-bilan .
La courbe pH= f(Vb) nous permet de repérer facilement le point d'équivalence E . On peut utiliser la méthode des tangentes pour déterminer E .
Q10)Construire le point E et déterminer ses coordonnées.
c)L'indicateur coloré :le BBT
Un indicateur coloré est caractérisé par sa zone de virage . Pour le BBT , elle se situe entre pH1= 6 et pH2=7,6 . Les teintes correspondantes sont :
*pour pH < 6 :jaune
*pour pH > 7,6 :beu
* pour la zone de virage : bleu-vert
Q11)On note HIn/In- le couple acide/base de l'indicateur coloré . Quelle est la couleur de la forme acide ? de la forme basique ?
Q12)Expliquez la teinte de l'indicateur coloré dans la zone de virage .
Tracer sur le graphique une bande dont les limites correspondent à pH1 et pH2 .
Q13)L'affirmation suivante est-elle correcte : " L'équivalence est atteinte lorsque l'indicateur coloré change de teinte " ? Commentez .
Q14)Proposez un protocole qui permette de repérer l'équivalence lorsqu'on ne dispose pas de pH-mètre , mais uniquement d'indicateurs colorés .
d)Equivalence théorique et équivalence expérimentale :
On appelle Vb,e l'abscisse du point d'équivalence .
Q15)Calculer le nombre na de moles d'acide éthanoïque introduites dans 20 mL de solution , sachant que la concentration de la solution d'acide éthanoïque est Ca = 0,1 mol.L-1 .
Q16)Calculer le nombre nb de moles d'ions OH- versés à l'équivalence sachant que la concentration de la solution de soude est Cb = 0,1 mol.L-1.
Q17)Les concentrations de la solution acide et de la solution basique indiquées ci- dessus sont-elles exactes ? Commentez .
Correction :
Q1)Masse molaire de NaOH : 23+16+1=40 g.mol
-1 . Pour préparer 1 litre de solution décimolaire de soude , il faut donc peser 4 g d'hydroxyde de sodium et les verser dans une fiole jaugée de 1 L .Ensuite ajouter de l'eau distillée( en agitant entre deux ajouts successifs ) jusqu'au trait de jauge . Puis agiter pour bien homogénéiser la solution obtenue .
Q2) log 1 = 0 ; log 0,1 = -1 ; log 0,01 = -2
Q3)Mesures de pH :
* acide chlorhydrique décimolaire : 1,2 - solution acide
* acide éthanoïque décimolaire : 3 - acide
* soude centimolaire : 12 - basique .
Q4)La solution est jaune après l'ajout de BBT
Q5)
Vb (mL |
0 |
1 |
3 |
5 |
10 |
15 |
18 |
18,5 |
19 |
19,5 |
20 |
20,5 |
21 |
21,5 |
22 |
24 |
pH |
2,9 |
3,5 |
4 |
4,3 |
4,8 |
5,2 |
5,7 |
5,9 |
6 |
6,4 |
8,7 |
11 |
11,4 |
11,5 |
11,7 |
12 |
26 |
30 |
35 |
40 |
12,4 |
12,3 |
12,4 |
12,5 |
*l'indicateur coloré change de teinte autour de 20 mL
* La solution prend alors une teinte bleue .
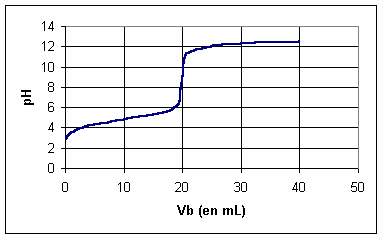
Q6)
Q7)L'acide éthanoïque est un acide CH
3COOH = CH3COO- + H+ (l'acide cède un proton)L'ion éthanoate CH
3COO- est sa base conjuguée .Q8)OH
- est une base : OH- + H+ = H2O (la base capte un proton)H
2O est l'acide confugué de la base OH- .Q9) CH
3COOH + OH- -------> CH3COO- + H2OQ10)Coordonnées du point d'équivalence : pH = 8,5 ; V
b,e = 20 mLQ11) Hin : couleur jaune (forme prédominante à pH<6)
In
- : couleur bleue (forme prédominante à pH> 7,6)Q12)Dans la zone de virage , la valeur du pH change brutalement , d'où le changement de teinte entre pH=6 et pH=7,6 .
Q13)
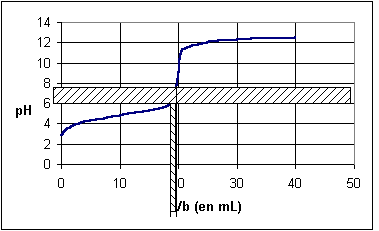
A la bande de pH [6-7,6] correspond un intervalle de volume [18 - 19] mL . Nous pouvons donc affirmer que l'indicateur change de teinte lorsqu'on verse entre 18 et 19 mL de solution de soude . Or cette zone est relativement proche de l'équivalence , d'où l'affirmation proposée .
En fait en prenant non pas le BBT comme indicateur coloré , mais de la phtaléine , le changement de teinte de l'indicateur permettrait d'apprécier avec davantage de précision l'équivalence .
Q14)On met l'acide et quelques gouttes d'indicateur coloré dans le bécher et on verse de la solution basique contenue dans la burette jusqu'à ce que le changement de teinte persiste . Le volume mesuré avec la burette permet de déterminer le volume de base versé pour atteindre l'équivalence .
Q15)n
a= Ca Va = 0,1* 20 10-3 = 2 10-4 molQ16)n
b = CbVb = 2 10-4 mol .Q17)Les concentrations des solutions acide et basique sont donc exactes . Au cas où les deux valeurs précédentes n'auraient pas été identiques , nous aurions pu penser :
* à une mauvaise préparation de la solution titrante (la soude)
* à un prélèvement imprécis de la solution acide .