TP C4 CONDUCTANCE et CONDUCTIVITE
l) Objectif
Découvrir une méthode de détermination de la conductance d'une portion de solution
Etudier l'influence de la concentration sur la conductance d'une solution.
Il)Caractère conducteur de quelques solutions aqueuses.
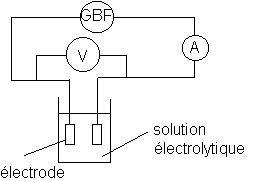
l) Schéma du montage.
Réaliser le montage ci-dessous :
GBF en mode sinusoïdale de fréquence N==500Hz et de tension entre les électrodes UAB= 0,5 V.

2) Expérience.
Les électrodes sont complètement immergées tour à tour dans l'une des solutions suivantes
• Eau distillée
• Eau salée
• Eau sucrée
• Solution d'hydroxyde de sodium
• Solution d'acide chlorhydrique
• Solution de sulfate de cuivre
Attention, nettoyer pour chaque mesure le tube à essais.
Mesurer dans chacun des cas l'intensité du courant qui circule dans le circuit.
Relever les valeurs dans le tableau ci-dessous.
3) Tableau de mesures.
| Solution | Eau distillée | Eau salée | Eau sucrée | Hydroxyde de sodium | Acide chlorhydrique | Sulfate de cuivre |
| I en mA |
4) Questions.
Ql : A partir de ces résultats, classer les solutions en deux catégories. Que peut-on en
déduire quant à la nature des solutions ?
III) La conductance.
l) Définition.
On appelle conductance G de la portion de solution entre les deux électrodes, le rapport du courant l traversant le circuit sur la tension UAB aux bornes des électrodes.
G s'exprime en Siemens : symbole S.
2) Calcul de la conductance d'une solution.
Calculer la conductance G pour chacune des solutions précédentes.
Relever les résultats dans le tableau suivant :
| Solution | Eau distillée | Eau salée | Eau sucrée | Hydroxyde de sodium | Acide chlorhydrique | Sulfate de cuivre |
| G en S |
Q2 : Quelle est la relation qui lie G et R (la résistance) ?
IV) Influence de la concentration.
l) Expériences et mesures.
a) Prendre dans un bêcher environ 100 ml de la solution mère d'acide chlorhydrique de
concentration c = 1,1 mol/L. (groupe A)
Mesurer l'intensité l de la solution et en déduire la valeur de la conductance.
Relever ces valeurs dans le tableau ci-dessous.
b) Prélever 50 ml de la solution mère avec une éprouvette graduée (groupe A).
Verser ces 50 ml dans une fiole jaugée de 100 ml et compléter jusqu'au trait de jauge avec de
l'eau distillée.
Q3 : Quelle est la concentration de cette solution ?
Mesurer l, en déduire G et relever ces valeurs dans le tableau ci-dessous.
c) Prélever 20 ml de la solution mère avec une pipette de 20 ml et une propipette (groupe A).
Verser ces 20 ml dans une fiole jaugée de 100 ml et compléter jusqu'au trait de jauge avec de
l'eau distillée.
Q4)Quelle est la concentration de cette solution ?
Mesurer l, en déduire G et relever ces valeurs dans le tableau ci-dessous
d) Prélever 10 ml de la solution mère avec une pipette de 10 ml et une propipette (groupe A).
Verser ces 10 ml dans une fiole jaugée de 100 ml et compléter jusqu'au trait de jauge avec de
l'eau distillée.
Q5 : Quelle est la concentration de cette solution ?
Mesurer l, en déduire G et relever ces valeurs dans le tableau ci-dessous.
e) Prélever 5 ml de la solution mère avec une pipette de 10 ml graduée et une propipette (groupe B).
Verser ces 5 ml dans une fiole jaugée de 100 ml et compléter jusqu'au trait de jauge avec de
l'eau distillée.
Q6 : Quelle est la concentration de cette solution ?
Mesurer l, en déduire G et relever ces valeurs dans le tableau ci-dessous.
f) Prélever 2 ml de la solution mère avec une pipette de 10 ml graduée et une propipette (groupe B).
Verser ces 2 ml dans une fiole jaugée de 100 ml et compléter jusqu'au trait de jauge avec de
l'eau distillée.
Q7 : Quelle est la concentration de cette solution ?
Mesurer l, en déduire G et relever ces valeurs dans le tableau ci-dessous.
g) Prélever l ml de la solution mère avec une pipette de 10 ml graduée et une propipette (groupe B).
Verser ces l ml dans une fiole jaugée de 100 ml et compléterjusqu'au trait de jauge avec de
l'eau distillée.
Q8 : Quelle est la concentration de cette solution ?
Mesurer l, en déduire G et relever ces valeurs dans le tableau ci-dessous.
2) Tableau de mesures
| C (mol/L) | 1.10-2 | ||||||
| I (mA) | |||||||
| G (S) |
3) Graphe.
Trace le graphe G en fonction de C.
4) Conclusion.
Q9 : Que peut-on en conclure ?
5) Détermination de la concentration inconnue d'une solution.
Q10)Mesurer la conductance G de la solution de concentration inconnue :
l = donc G =
Placer cette valeur sur le graphe précédent et en déduire la valeur de la concentration de la
solution.
C=
V) Autres grandeurs d'influence.
La conductance est :
*Proportionnelle à la surface S d'une face des électrodes.
*Inversement proportionnelle à la distance L entre les deux électrodes.
*Augmente avec la température.
*Dépend de l'état de surface des électrodes.
La modification d'une grandeur d'influence modifie la valeur de la conductance.
VI) La conductivité d'une solution ionique.
l) Définition.
La conductivité est une propriété caractéristique d'une solution. Son unité est le siemens par
mètre.
![]()
G est la conductance (S), L la longueur entre les deux plaques (m) et S la surface d'une plaque (m2).
Q11)Quelle est l'unité de conductivité ? Justifiez
Il existe des appareils appelés conductimètres, qui permettent de mesurer directement la conductivité ou la conductance.
2) Mesures.
Q12)Déterminer L et S pour les électrodes utilisées .
Q13)Calculer la conductivité des solutions du III
| Solution | Eau distillée | Eau salée | Eau sucrée | Hydroxyde de sodium | Acide chlorhydrique | Sulfate de cuivre |
| s en S.m-1 |
Réponses aux questions :
Q1)
| Solution | Eau distillée | Eau salée | Eau sucrée | Hydroxyde de sodium | Acide chlorhydrique | Sulfate de cuivre |
| I en mA | 0,01 | 3,5 | 0,01 | 8,5 | 15 | 8,5 |
Les résultats font apparaître que :
* l'eau salée , la solution de soude (NaOH), la solution d'acide chlorhydrique et la solution de sulfate de cuivre conduisent bien le courant électrique . Ces solutions contiennent des ions . Ce sont des électrolytes .
* l'eau distillée et l'eau sucrée ne conduisent pas bien le courant électrique : elles ne contiennent (aux impuretés près) pratiquement pas d'ions .
Q2)
| Solution | Eau distillée | Eau salée | Eau sucrée | Hydroxyde de sodium | Acide chlorhydrique | Sulfate de cuivre |
| G en S | 2 10-5 | 7 10-3 | 2 10-5 | 0,017 | 0,030 | 0,017 |
G=1/R = I/U
Q3)solution mère C=1 10
-2 mol/L . Solution fille C'= 5 10-3 mol/LQ4) C'= 2 10
-3 mol/LQ5) C'=1 10
-3 mol/LQ6) C'=5 10
-4 mol/LQ7) C'= 2 10
-4 mol/LQ8) C'= 10 10
-4 mol/LQ9)U
AB = 0,5 V (valeur efficace en régime sinusoïdal à f=500 Hz)| C (mol/L) | 1.10-2 | 5 10-3 | 2 10-3 | 1 10-3 | 5 10-4 | 2 10-4 | 1 10-4 |
| I (mA) | 5,5 | 3 | 1,3 | 0,75 | 0,6 | 0,17 | 0,07 |
| G (mS) | 11 | 6 | 2,6 | 1,5 | 1,2 | 0,34 | 0,14 |

G(C) étant une fonction linéaire (droite qui passe par l'origine) , nous en déduisons que le conductivité est proportionnelle à la concentration .
Q10) Si I=2,5 mA G= 5 mS . A partir de la courbe , nous constatons que le point d'ordonnée G=5 mS a pour abscisse C= 4 10
-3 mol/L : c'est la concentration de la solution inconnue .Q11)
s en S.m-1 . (S*m2/m)Q12) S=1 cm
2 L = 1 cmQ13)
| Solution | Eau distillée | Eau salée | Eau sucrée | Hydroxyde de sodium | Acide chlorhydrique | Sulfate de cuivre |
| s en S.m-1 | 0,002 | 0,7 | 0,002 | 1,7 | 3 | 1,7 |