I/Objectif du TP :
Déterminer la quantité de matière de gaz produite au cours d'une transformation par mesure de la pression .
II/Matétiel utilisé :
*Hydrigénocarbonate de sodium ,solution d'acide éthanoïque (1 mol/L) , BBT , eau de chaux
*Tubes à essais, tube en verre coudé , ballon de 1 L, burette graduée, spatule, bouchon muni d'un tube en verre .
*Bec Bunsen, balance , agitateur magnétique, capteur de pression ,multimètre, alimentation -15/+15 V .
III/Etude qualitative de la transformation :
a)Les réactifs
*hydrogénocarbonate : NaHCO3 (Na+,HCO3-). * acide éthanoïque :CH3COOH (noté AH)
b)La réaction chimique :
![]()
*La solution finale contient des ions Na+ .
*On obtient donc un dégagement de gaz carbonique CO2 : l'eau de chaux permet de le mettre en évidence .
c)Observation :
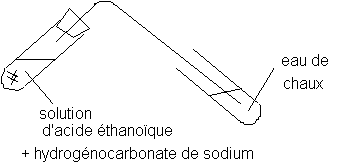
Dans un tube à essais, introduire quelques mL d'une solution d'acide éthanoïque et une pointe de spatule d'hydrogénocarbonate de sodium .
Identifier le gaz obtenu par le test à l'eau de chaux .
Q1)Observation et conclusion sur la formation de CO2
Q2)Réalisez le test à la flamme pour mettre en évidence la présence d'ions Na
+dans le milieu réactionnel (utilser un agitateur en verre) . ConclureIV/Etude quantitative :
a)Description de l'expérience :
*Les groupes d'élèves disposent chacun d'un ballon et d'un bouchon adapté percé, dans lequel on introduit un tube en verre, prolongé par le tuyau d'un capteur de pression .
* Le capteur de pression est alimenté par une alimentation symétrique -15/+15V . La sortie du capteur de pression est connectée sur un multimètre calibré sur 2 V continu .
* Le volume de l'ensemble {ballon + tuyau } est V= ........ L .
*Chaque groupe introduit dans le ballon un agitateur magnétique , puis à l'aide d'une burette graduée un volume différent VA d'une solution d'acide éthanoïque de concentration molaire égale à 1 mol.L-1 . Les différentes valeurs de VA sont notées sur votre copie dans un tableau identique à celui présenté page suivante .
*Ajouter ensuite le complément en eau distillée (utilisation d'une pipette graduée) V'=20 - VA = ........ mL de façon à ce que le volume total de la solution soit égal à 20 mL . Le volume de solution sera ainsi le même pour tous les groupes .
Ajouter quelques gouttes de bleu de bromothymol .
*Boucher le ballon . Réaliser le montage dont le schéma est ci-dessous :
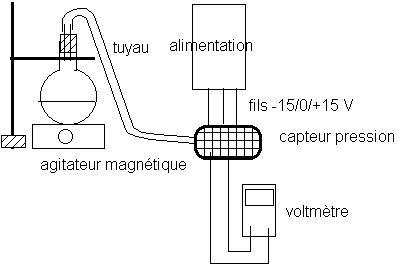
Mettre en marche l'alimentation et le voltmètre et mesurer la tension U0 indiquée par le voltmètre .
*Introduire dans le ballon un papier absorbant contenant 1g (déterrminé par pesée) de NaHCO3 , puis reboucher immédiatement . Agiter (agitateur magnétique).
*Relever la valeur de la tension U à la fin de la transformation .
A la fin de la réaction le volume occupé par le gaz est Vg = V-20 (volumes en mL) .
b)Calculs et mesures :
Tenant compte des caractéristiques du capteur de pression et utilisant la loi des gaz parfaits , la quantité (exprimée en mmol ) de CO2 formé au cours de la réaction est donnée par l'expression :
![]()
T=.............. K est la température exprimée en Kelvin
U est exprimée en volts et le volume V en mL
*Calcul de la quantité d'acide éthanoïque n(AH) exprimée en mmol: n(AH)=C.VA avec C=1 mol.L-1 , VA étant exprimé ici en mL .
*Calcul de la quantité d'hydrogénocarbonate de sodium exprimée en mmol (celle-ci est la même pour tous les groupes) .
Sa masse molaire est M= 23+1+12+3*16= 84 g.mol-1 . n(NaHCO3) = m/M = 12.10-3 mol = 12 mmol .
Q3)Quel est le réactif limitant ?
c)Tableau récapitulatif :
V A (mL) |
4 |
5 |
6 |
8 |
10 |
11 |
12 |
14 |
16 |
18 |
19 |
|
état initial |
n(AH) en mmol |
|||||||||||
n(NaHCO 3) |
||||||||||||
U-U 0 (V) |
||||||||||||
état final |
n(CO 2) (mmol) |
|||||||||||
reste acide ? |
Q4)Tracer la courbe n(CO
2) =f(n(AH)). Quelle est la nature de cette courbe ? Donnez l'équation de la courbe .Q5)D'après l'équation-bilan , l'acide étant le réactif limitant , la quantité de CO
2 formée (notée ici n(CO2)) est égale à la quantité d'acide (notée ici n(AH)) ayant réagi .Les résultats obtenus permettent-ils de le vérifier ?VI/Exercice : n°20 page 52 .
Réponses aux questions .
Q1)L'eau de chaux se trouble , ce qui met en évidence la formation de CO2 au cours de la réaction entre l'acide éthanoïque et l'hydrogénocarbonate de sodium .
Q2)La flamme devient jaune à cause de la présence d'ions Na+ .
Q3) n(AH) = CAVA n(NaHCO3) = 12 mmol
VA (mL) |
4 |
5 |
6 |
8 |
10 |
11 |
12 |
14 |
16 |
18 |
19 |
n(AH) en mmol |
4 |
5 |
6 |
8 |
10 |
11 |
12 |
14 |
16 |
18 |
19 |
n(NaHCO3) |
12 |
12 |
12 |
12 |
12 |
12 |
12 |
12 |
12 |
12 |
12 |
La réaction s'effectue mole à mole entre l'acide et l'hydrogénocarbonate , si bien que :
* si n(AH) < n(NaHCO3) : le réactif limitant est l'acide . C'est le cas ici lorsque VA < 12 mL
* si n(AH)=n(NaHCO3) : les réactifs sont mélangés dans les proportions stoechiométriques , ce qui correspond au cas VA=12 mL
* si n(AH) < n(NaHCO3) : le réactif limitant est l'hydrogénocarbonate de sodium , ci qui correspond ici à VA > 12 mL
Q4)U0= 1,1 V ![]() en mmol (V en mL , U et U0 en V et T en K) . V = 280 mL ; T=300 K
en mmol (V en mL , U et U0 en V et T en K) . V = 280 mL ; T=300 K
VA (mL) |
4 |
5 |
6 |
8 |
10 |
11 |
12 |
14 |
16 |
18 |
19 |
U-U0 (V) |
0,39 |
0,49 |
0,58 |
0,80 |
0,98 |
1,07 |
1,17 |
1,17 |
1,17 |
1,17 |
1,17 |
n(CO2) (mmol) |
3,8 |
4,8 |
5,7 |
7,8 |
9,6 |
10,5 |
11,5 |
11,5 |
11,5 |
11,5 |
11,5 |
reste acide ? |
0,2 |
0,2 |
0,3 |
0,2 |
0,4 |
0,5 |
0,5 |
2,5 |
4,5 |
6,5 |
7,5 |
les valeurs numériques de la dernière ligne sont à considérer avec précaution :elles supposent que la pression a été mesurée avec une grande précision , ce qui n'est certainement pas le cas
Q5)Les résultats permettent quasiment de vérifier , lorsque l'acide est le réactif limitant, que la quantité de CO2 formée est égale à la quantité d'acide ayant réagi .
Exercice 20 page 52 :
1)Les réactifs sont introduits dans les proportions stoechiométriques si :
![]()
Or la quantité d'oxyde de fer introduite est : n(Fe2O3 introduit) = 1 mol . Il faut donc apporter 2 moles d'aluminium
2) m(Fe2O3) = n*M = 1*(55,8*2+3*16)=159,6 g
m(Al) = 2*27= 54 g
La masse totale des réactifs est donc : 213,6 g
3)
Equation chimique |
Fe2O3 + 2Al -------> Al2O3 + 2Fe | ||||
Etat du système |
Avancement (mol) |
Quantités de matière |
|||
Etat initial |
0 |
1 |
2 |
||
En cours de trans. |
X |
1 - X |
2 - 2X |
X |
2X |
Etat final |
Xmax=1 |
0 |
0 |
1 |
2 |
4) On obtient 2 moles de Fe , soit 2*55,8 = 111,6 g de fer et 1 mole d'oxyde d'aluminium soit ( 2*27+3*16 = 102 g d'oxyde d'aluminium . Au total nous obtenons par conséquent 213,6 g de produit . La masse est donc conservée au cours de la transformation chimique .