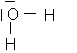
Annales 2002 : 75
1/-a :
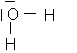
L'oxygène satisfait ainsi à la règle de l'octet et l'hydrogène à celle du duet (structures électroniques de gaz râres)
b:

c:la molécule d'eau est polaire car le barycentre des charges positives (protons) ne coïncide pas avec le barycentre des charges négatives (électrons) . Cela est lié au fait que l'oxygène est plus électronégatif que l'hydrogène .
2/
* Formule semi-développée du méthoxyméthane :
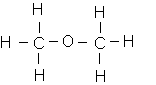
Cette molécule n'a que des groupements C-H et il n'y a pas de possibilités de liaisons hydrogène avec l'eau : cette molécule est hydrophobe . Ces molécules sont rejetées hors de l'eau : elles sont insolubles .
* éthanol
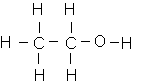
Cette molécule possède un groupement O-H . Celui-ci va permettre d'établir avec l'eau , des liaisons hydrogène : cette molécule est hydrophile et l'éthanol est par conséquent soluble dans l'eau .
3/-a:
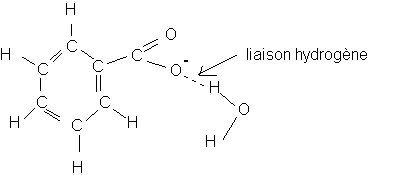
La liaison hydrogène a lieu entre l'atome d'oxygène de l'ion benzoate portant la charge négative -e et un atome d'hydrogène H (+
d) de la molécule d'eau . Cette liaison est particulièrement forte car l'atome d'oxygène a une charge négative (dans ce cas ,la charge est totale et non partielle (-d) ).b:* la liaison précédente ne peut plus s'établir puisque dans la molécule de l'acide benzoïque, l'oxygène chrargé négativement dans l'ion benzoate n'est "plus libre" .
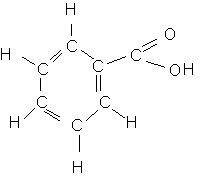
Ainsi les liaisons hydrogène entre l'acide benzoïque et l'eau sont plus difficules à établir et elles sont surtout plus faibles . Et de ce fait , l'acide benzoïque n'est pas soluble dans l'eau .
* L'espèce acide prédomine si pH<pK
a =4,2