Chap C3 : Solutions électrolytiques
I/Exemples de cristaux :
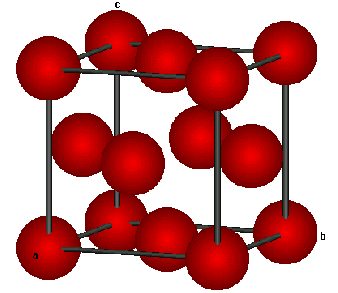
a)Un cristal métallique : le cuivre

Le métal cuivre est constitué d'atomes de cuivre. Ceux-ci sont situés aux sommets et aux centres des faces de cubes "empilés" les uns sur les autres .
b)Un cristal ionique :NaCl
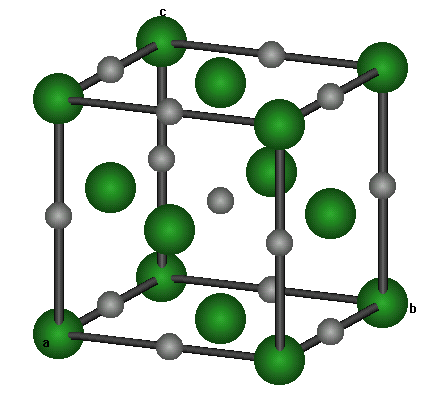
Le sel NaCl , est en fait constitué d'ions Na+ et Cl-
Sur le schéma ci-contre , les ions Cl
- sont situés aux sommets et au centre des faces de cubes "empilés" les uns sur les autres .Les ions Na
+ sont situés au milieu des arêtes avec de plus un ion Na+ au centre du cube .
c)Rôle des forces électrostatiques
Elles permettent d'assurer la cohésion des cristaux (voir exercice de physique n°41 page 36.
II/Mise en solution d'un solide ionique :
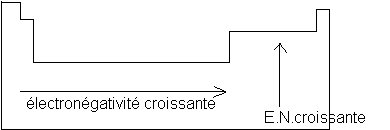
a) électronégativité des éléments
Un atome est d'autant plus électronégatif qu'il est avide d'électrons . On peut chercher à comparer l'électronégativité des différents éléments de la classification périodique .
En règle générale :
* Des éléments d'une même ligne de la classification périodique sont de plus en plus électronégatifs lorqu'on lit la table de gauche à droite .
* Des éléments d'une même colonne sont de plus en plus électronégatifs lorsqu'on lit la table de bas en haut .
b)La molécule d'eau est polaire :

Comme l'oxygène est plus électronégatif que l'hydrogène , la géométrie de la molécule d'eau est telle que les baycentres des charges négatives et des charges positives ne coïncident pas : on dit que la molécule d'eau est polaire .
Le caractère polaire de la molécule d'eau va favoriser les interactions avec les ions lors de la mise en solution de corps ioniques .
Remarques :
1/si la molécule d'eau était linéaire , elle ne serait pas polaire (voir livre page 29 et 30)
2/ barycentre : Si P est le barycentre des charges positives , alors :
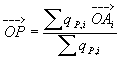
c)solutions aqueuses électrolytiques :
expérience préliminaire : On dissout dans trois béchers différents :
* du chlorure de sodium NaCl ( Na+ et Cl-): la température ne varie pas .
* de l'hydroxyde de sodium NaOH (Na+ et OH-) : la température augmente
* du chlorure d'ammonium : NH4Cl (NH4+ et Cl- ) : la température diminue
On peut expliquer les effets différents sur la température de la dissolution des solides ioniques en décomposant la dissolution dans le solvant (ici l'eau) en deux phases :
*phase 1: dissociation du soluté . Cette phase est endothermique (elle absorbe de l'énergie au solvant) . Si cette phase était la seule existante , toutes les dissolution s'accompagneraient d'une baisse de température .
voir fig 16 livre page 31
Au cours de cette phase , la "face" positive de la molécule d'eau a tendance à attirer les ions négatifs (anions) , alors que la "face" négative a tendance à attirer les ions positifs (cations). La conséquence de ce processus est la dispersion des ions dans le solvant .
*phase 2 :Les ions ont tendance à s'entourer de molécules d'eau (un peu comme si les gardes du corps entouraient un homme politique pour le protéger !) : c'est le phénomène de solvatation .
voir fig 17 du livre page 31
Cette phase est exothermique . Si elle était la seule existante, toutes les dissolutions s'accompagneraient d'une élévation de température .
Finalement suivant que le bilan énergétique d'une phase l'emporte ou pas sur l'autre , le bilan global est , athermique (NaCl) , exothermique (NaOH) ou endothermique (NH4Cl)
d)Equation chimique de la dissolution :
* cas particulier de NaCl :![]()
* cas général : ![]() , ce
qui conduit au tableau :
, ce
qui conduit au tableau :
Equation |
|
|||
Etat |
Avancement |
Quantités de matière |
||
initial |
0 |
n |
0 |
0 |
intermédiaire |
X |
n-X |
m*X |
n*X |
final |
X max= n |
0 |
m*n |
p*n |
e)Concentrations :
*concentration de soluté apporté : ![]()
n est le nombre de moles de soluté introduites pour préparer le volume V de solution
*concentration des espèces présentes en solution : ![]()
n est le nombre de moles de l'espèce X présentes dans le volume V de la solution
Les deux notations ne sont pas à confondre . Dans le cas précédent , pour une dissolution totale du soluté , si la concentration en soluté est C , alors on a :
![]()
III/Conductivité des solutions ioniques
a)Courant électrique dans une solution ionique :
expérience :L'expérience de migration des ions (livre , doc 3 page 59) permet de montrer que dans une solution ionique :
*les ions positifs (ou cations) se déplacent vers la cathode (électrode reliée au pôle négatif d'un générateur)
*les ions négatifs (ou anions ) se déplacent vers l'anode (électrode reliée au pôle positif du générateur) .
Nous retiendrons que dans une solution il n'y a jamais de déplacement d'électrons libres (comme dans les métaux) . Le courant est dû à un déplacement d'ions . Les ions positifs vont dans le sens du courant .
b)Conductance et conductivité :
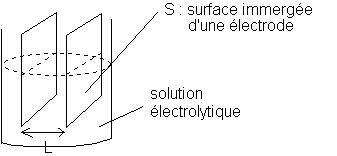
Les électrodes sont reliées à un générateur basse fréquence (G.B.F.) qui délivre une tension sinusoidale .
U est la tension efficace aux bornes des plaques (mesurée avec un voltmètre utilisé en alternatif).
I est l'intensité efficace (mesurée avec un ampèremètre utilisé en alternatif )
* U=RI : U en V , I en A , R en W ; R est la résistance de la portion de solution comprise entre les électrodes .
* On pose G=1/R ; G en siemens .G est la conductance de la portion de solution électrolytique . Nous pouvons alors écrire :
![]()
* ![]()
S : surface immergée d'un électrode en m2 .
L : distance entre les électrodes en m
s
: Conductivité de la solution en S.m-1 . Elle dépend :+ de la concentration de la solution (
s augmente avec la concentration)+ de la nature de l'électrolyte : la taille et la charge des ions ont une influence sur
s .+ de la température :
s augmente avec la températurec)Conductivité molaire ionique .
On suppose que les solutions ne sont pas trop concentrées (C< 10
-2 mol.L-1)* La solution contient un seul soluté monochargé M
+X-![]()
l
(M+aq) : conductivité molaire ionique de l'ion M+ en S.m2.mol-1 .l
(X-aq ) : conductivité molaire ionique de l'ion M+ en S.m2.mol-1 .*solution ionique quelconque :
![]() lorsqu'il y a p ions monochargés en
solution
lorsqu'il y a p ions monochargés en
solution
La conductivité molaire ionique dépend de la température et de la nature du solvant .
voir le tableau page 73
IV/Exercices :
n°s 1,2,4,6,8,10,12,16,21 et 31 pages 36 à 37
Exercice résolu page 36
n°s 2,4,10,13,15 et 18 pages 66 à 68
Exercice résolu page 75
n°s 1,3,7,9,13 et 19 pages 76 à 79