CHIMIE – 2de –Exercices de révision
Exercice 1.
On considère un
atome dont le noyau est caractérisé par le symbole
suivant:
![]() .
.
1. Déterminer, en justifiant les réponses, la composition du noyau de cet atome (nombre de protons, nombre de neutrons).
2. Déterminer en justifiant la réponse, le nombre d'électrons gravitant autour du noyau de cet atome.
Exercice 2.
Le noyau d'un atome de fer est caractérisé par les deux nombres Z=26 et A=56.
1. Déterminer une masse approchée d'un atome de fer.
2. Quel est approximativement le nombre d'atomes de fer présents dans un clou en fer de 10g?
Donnée: masse d'un nucléon: mn=1,7.10-27kg.
Exercice 3.
La formule électronique d'un atome est: (K)2(L)8(M)7.
1. Quelle est la couche externe de cet atome?
2. Combien d'électrons périphériques cet atome possède-t-il?
3. Donner le symbole de son noyau, sachant que l'élément correspondant est le chlore et que son noyau comporte 18 neutrons.
4. Cet atome gagne facilement un électron pour donner l'ion chlorure. Donner la répartition des électrons de l'ion chlorure.
Exercice 4.
Le numéro atomique du sodium est Z=11 et celui du magnésium est Z=12.
1. Comparer les formules électroniques des ions sodium Na+ et magnésium Mg2+.
2. Déterminer l'élément dont l'anion ne portant qu'une seule charge a la même formule électronique que celles des ions sodium Na+ et magnésium Mg2+.
Voici le modèle moléculaire de la molécule d'éthanal.

1. Quelle est sa formule brute?
2. Quelle est sa représentation de Lewis?
3.Quelle est sa formule semi-développée?
1. Établir la représentation de Lewis de la molécule de sulfure d'hydrogène H2S.
2. Rechercher la disposition spatiale qui éloigne au maximum les doublets et en déduire la géométrie de la molécule de sulfure d'hydrogène.
3. Peut-on représenter cette molécule en utilisant la représentation de Cram?
La couche électronique externe d'un atome est la couche (M). Elle comporte 1 électron.
1. Dans quelle ligne et quelle colonne de la classification périodique se situe l'élément chimique correspondant?
2. Donner son numéro atomique et l'identifier.
3. Quel ion monoatomique cet atome est-il susceptible de donner? Justifier.
4. Citer deux éléments appartenant à la même famille. Nommer cette famille.
Masse d'aluminium
1. Quelle est la masse de 1,25 mol d'aluminium?
2. Quelle est la masse d'un atome d'aluminium?
Dioxygène dans le CNTP (Vm= 22 L.mol-1)
1. Quel est le volume occupé par 0,80 mol de dioxygène dans les conditions normales de température et de pression?
2. Quel est le volume occupé par 7,80g de dioxygène dans les conditions normales de température et de pression?
3. Quelle est la quantité de matière contenue dans 15,0L de dioxygène?
4. Quelle est la masse de 22,0L de dioxygène?
L'éthanol pur est un liquide de masse volumique ρ=0,79g.cm-3 et de formule C2H5OH.
1. Quel est le volume occupé par 1,20 mol d'éthanol pur?
2. Quelle quantité de matière y a-t-il dans 6,0cm3 de ce liquide?
La vitamine C, ou acide ascorbique C6H8O6, est souvent prescrite en cas de grippe ou en période de convalescence. Elle peut se présenter en sachets contenant entre autres, une masse m1=1,00g de vitamine C et une masse m2=6,05g de saccharose de formule C6H22O11.
1. Déterminer les quantités de matière de vitamine C et de saccharose contenues dans un sachet.
2. On dissout le contenu d'un de ces sachets dans un verre d'eau. Sachant que le volume de la solution obtenue est V=125mL, déterminer les concentrations molaires de ces solutés dans la solution.
Au laboratoire, on dispose d'une éprouvette graduée de 1 litre et d'une solution de saccharose de concentration molaire 0,100mol.L-1.
1. On introduit 50mL de la solution de saccharose dans l'éprouvette graduée. Jusqu'à quelle graduation de l'éprouvette doit-on ajouter de l'eau distillée pour que la concentration de la solution obtenue soit de 2,50.10-2mol.L-1?
2. On souhaite maintenant réaliser 500mL d'une solution de saccharose de concentration 2,50.10-2mol.L-1. Quel volume de la solution initiale faut-il introduire dans l'éprouvette graduée avant de compléter le volume à 500mL avec de l'eau distillée?
On désire préparer 500mL d'une solution de sulfate de cuivre de concentration molaire 2,00.10-1mol.L-1. On utilise pour cela du sulfate de cuivre anhydre de formule CuSO4.
1. Que signifie le mot anhydre?
2. Quelle masse de soluté doit on peser pour réaliser cette solution? Décrire brièvement le protocole expérimental utilisé pour réaliser cette opération.
Exercice 14 :
Equilibrer les équations de réactions suivantes :
a-C2H8O + O2 -----------> CO2+H2O
b-Cu + O2 -----> CuO
c-NH3+O2 ----> NO+H2O
d-Al + CO2 ----> Al2O2 + C
Exercice 15 :
Les ions chlorures réagissent avec les ions plomb selon l'équation suivante:
Pb2+ + 2 Cl-
![]() PbCl2
PbCl2
On fait réagir 30,0.10-3 mol d'ions Pb2+ avec 40.10-3 mol d'ions Cl-.
1. Dresser le tableau d'avancement de la réaction.
2. Rappeler ce qu'on appelle réactif limitant.
3. Déduire du tableau la quantité de matière d'ions Cl- restants dans l'état final si l'on considère que l'ion Pb2+ est le réactif limitant. Que peut-on dire du résultat obtenu?
4. En déduire la quantité de matière de chacun des réactifs et des produits dans l'état final.
5. Déterminer la masse de chlorure de plomb obtenu
Chimie 2de exercices de révision - correction
Exercice 1 :
1/Z numéro atomique : Z=11 . C'est le nombre de protons
A nombre de nucléons A=23 . Le nombre de neutrons est N=A-Z=23-11=12
2/L'atome est électriquement neutre . Comme la charge d'un proton est opposée à celle d'un électron (qP=- qe= 1,6.10-19 C) , l'atome contient autant de protons que d'électrons Ne= 11
Exercice 2 :
1/ Pour calculer la masse approchée d'un atome , on admet que protons et neutrons ont la même masse :
mn=mp = 1,7.10-27 Kg ( c'est la masse d'un nucléon).
La masse de l'atome est par conséquent matome= A*mn = 56*1,7.10-27 =9,5.10-26 kg
2/Le nombre d'atomes de fer contenus dans m=10 g= 10.10-3 kg est par conséquent : Natomes= 10.10-3/(9,5.10-26)=1023 atomes.
Exercice 3 :
1/La couche externe est la couche M
2/Cette couche contient 7 électrons
3/Le noyau de l'atome contient autant de protons que l'atome contient d'électrons (neutralité de l'atome). Le numéro atomique de cet atome est donc Z=2+8+7=17 . Le nombre de nucléons est A=N+Z=18+17=35 .
Le symbole du noyau de l'atome est par conséquent :
![]()
4/La
structure électronique de l'ion Cl- est
(K)2(L)8(M)8 (atome de chlore ayant
gagné 1 électron)
Exercice 4 :
1/La structure électronique du sodium Na est (K)2(L)8(M)1 . Celle de l'ion Na+ (atome de sodium ayant perdu un électron) est (K)2(L)8.
La structure électronique du magnésium Mg est :(K)2(L)8(M)2 . Celle de l'ion Mg2+ (atome ayant perdu 2 électrons) est (K)2(L)8
Autrement dit Na+ et Mg2+ ont la même structure électronique.
2/Nous cherchons l'ion négatif (une seule charge) qui a la même structure électronique que les ions précédemment cités . La structure électronique de l'atome correspondant est par conséquent : (K)2(L)7 , c'est à dire que pour cet atome Z=9 . Il s'agit du fluor F .
Exercice 5 :
1/La molécule contient 4 atomes d'hydrogène , 2 atomes de chlore et un atome d'oxygène . La formule brute est C2H4O
2/Représentation de Lewis de la molécule .
Intéressons nous d'abord à la représentation de Lewis de chacun des atomes :

La
représentation de Lewis de la molécule est :

3/Nous en déduisons la formule semi-développée : CH3- COH
Exercice 6 :
1/Représentation de Lewis de la molécule H2S . Une méthode similaire à celle de l'exercice précédent conduit à :

2/La géométrie qui éloigne au maximum les doublets correspond à la représentation qui est faite ci-dessus .
3/ Le 3 atomes sont dans le même plan . On peut utiliser la représentation de Cram suivante :

les deux liaisons H-S sont dans le plan de figure .
Exercice 7 :
1/Les électrons de cet atome sont répartis dans 3 couches : K,L et M . Cela signifie que l'élément chimique correspondant appartient à la troisième période de la classification périodique . Comme cet atome a 1 électron sur sa dernière couche il se situe dans la colonne I de la classification périodique.
2/La structure électronique est (K)2(L)8(M)1 , autrement dit Z=11 . Il s'agit du sodium Na
3/Si cet atome perd 1 électron , il a une structure électronique de gaz rare : celle du néon Ne . L'ion Na+ qui satisfait alors à la règle de l'octet est stable.
4/La famille de cet élément est celle des alcalins . Le lithium Li et le potassium K appartiennent à cette famille.
Exercice 8 :
1/MAl=27 g.mol-1 est la masse molaire atomique de l'aluminium . La masse de 1,25 mol d'aluminium est par conséquent m= 1,25*MAl =33,75 g.
2/matome= MAl/NA où NA est la constante d'Avogadro (NA=6,02.1023 mol-1 ).
matome = 27/6,02.1023 =4,5.10-23 g .
Exercice 9 :
1/ n=V/Vm . D'où V= n*Vm .
Avec n = 0,8 mol , nous obtenons V= 0,8*22 =17,6 L
2/n=m/M . La masse molaire du dioxygène est M=2*16=32 g.mol-1 . Dans m=7,8 g de dioxygène , il y a par conséquent n=7,8/32 =0,24 mol de O2 .En utilisant la formule de la question précédente , nous obtenons :
V= 0,24*22 =5,3 L . C'est le volume occupé par 7,8 g de dioxygène dans les conditions normales de température et de pression .
3/Dans V=15 L de dioxygène O2 il y a n=V/Vm= 15/22=0,68 mol de O2 .
4/ Dans V= 22 L de dioxygène , il y a n=V/Vm= 22/22= 1 mol de dioxygène . La masse correspondante est donc égale à la masse molaire du dioxygène , c'est à dire M=2*16 = 32 g de dioxygène.
Exercice 10 :
1/La masse molaire de l'éthanol est M=2*12+5+16+1=46 g.mol-1 . La masse de 1,20 mol d'éthanol est donc m= n* M = 1,2*46=55,2 g .
La formule de définition de la masse volumique s'écrit : ρ= m/V et donc V=m/ρ = 55,2 g /(0,79 g.cm-3)=0,70 cm3=0,70 mL= 7.10-4 L . C'est le volume occupé par 1,20 mol d'éthanol.
2/La masse de 6 cm3 de ce liquide est m = ρ*V = 0,79 g.cm-3*6 cm3 = 4,74 g . La quantité de matière correspondante est : n= m/M= 4,74/46=0,1 mol. C'est la quantité de matière en éthanol contenue dans 6 cm3 de ce liquide .
Remarque : la formule n=V/Vm est utilisée en général avec les gaz , pas avec les liquides !
Exercice 11 :
Calculons les masses molaires de la vitamine C et du saccharose .
MvitC = 6*12+8+6*16= 176 g.mol-1 ; Msaccharose= 6*12+22+11*16=270 g.mol-1 .
1/La quantité de vitamine C contenue dans un sachet est nvitC= m1/MvitC = 1/176=5,7.10-3 mol
La quantité de saccharose contenue dans un sachet est msaccharose= m2/Msaccharose= 6,05/270=2,2.10-2 mol.
2/ CvitC = nvitC/V=5,7.10-3 mol/0,125 L=4,5.10-2 mol.L-1 ; Csaccharose= nsaccharose/V=2,2.10-2/0,125= 0,17 mol.L-1
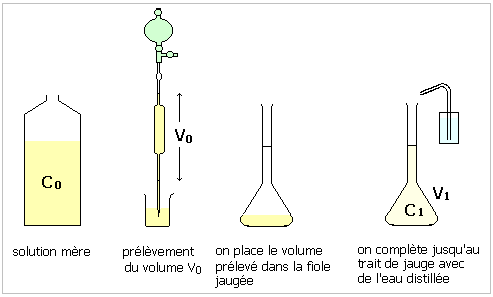
1. La manipulation
proposée consiste en une dilution. Il suffit de déterminer
le volume V de la solution fille réalisée.
C0V0
= CV donne V= 0,2L
On doit donc ajouter de l'eau distillée jusqu'à la graduation 200mL de l'éprouvette graduée.
2. La relation de
départ est identique à la précédente,
mais cette fois ci nous devons déterminer le volume Vo
prélevé dans la solution mère. V0=
0,125 L
On doit donc introduire dans l'éprouvette graduée
125mL de la solution initiale et compléter avec de l'eau
distillée jusqu'à la graduation 500mL.
1. Le mot anhydre signifie "sans eau". Le sulfate de cuivre anhydre ne contient donc pas d'eau.
2. Soit n(CuSO4) la quantité de matière de sulfate de cuivre nécessaire à la préparation de la solution.
n(CuSO4) = Co.V ; n(CuSO4) = 0,100mol
Soit M(CuSO4)
la masse molaire du sulfate de cuivre: M(CuSO4) =
159,6g.mol-1.
La masse m(CuSO4)
à peser sera donc: m(CuSO4) = n(CuSO4).M(CuSO4
m(CuSO4) = 16,0g
Mode opératoire:

2. Le sulfate de cuivre pentahydraté de formule CuSO4,5H2O contient 5 moles d'eau pour une mole de sulfate de cuivre. Sa masse molaire est donc: M(CuSO4,5H2O) = 249,6g.mol-1.
La quantité de
sulfate de cuivre réellement pesée donc: n(CuSO4,5H20)
= 6,41.10-2mol
On en déduit la concentration Co
de la solution obtenue: Co = 1,28.10-1mol.L-1
3. Soient:
Co: Concentration de la solution mère. ; Vo: Volume prélevé dans la solution mère. ;C: Concentration de la solution fille.
Mode opératoire Vo = 1,02.10-2L =(10,2=mL)
Exercice 14 :
a-C2H8O + 7/2O2 -----------> 2CO2+4H2O
b-Cu + 1/2O2 -----> CuO
c-2NH3+5/2O2 ----> 2NO+3H2O
d-2Al + CO2 ----> Al2O2 + C
Exercice 15 :
1/
|
|
Pb2+ …..........+........................... 2Cl- --------->............ PbCl2 |
||
|
Etat initial |
30.10-3 mol |
40.10-3 mol |
0 |
|
Etat intermédiaire |
30.10-3 - X |
40.10-3 - 2X |
X |
|
Etat final Xmax= 20.10-3mol |
10.10-3 mol |
0 |
20.10-3 mol |
Calcul de Xmax :
30.10-3-X=0 donne X=30.10-3 mol ; 40.10-3-2X=0 donne X=20.10-3 mol
La plus petite de ces deux solutions est Xmax = 20.10-3 mol
2/Lorsqu'une réaction est totale , le réactif limitant est celui qui a totalement réagi à la fin de la réaction . Ici il s'agit des ions Cl- .
3/ Si Pb2+ était le réactif limitant , on aurait Xmax= 30.10-3 mol et du coup on aurait à la fin de la réaction :
ncl-final = 40.10-3 - 2*30.10-3 = - 20.10-3 mol . Nous obtenons un résultat négatif , ce qui est impossible . Autrement dit , dans le cas présent Pb2+ n'est pas le réactif limitant .
4/A l'état final il ne reste plus d'ions Cl- (réactif limitant) , il reste nPb2+final= 10.10-3 mol et la réaction a produit nPbCl2= 20.10-3 mol de chlorure de plomb PbCl2 .